Γιατί μερικά μόρια είναι πολικά και άλλα μη πολικά;
πολικά μόρια
* ανομοιόμορφη κατανομή ηλεκτρονίων: Σε πολικά μόρια, τα ηλεκτρόνια δεν μοιράζονται εξίσου μεταξύ των ατόμων. Αυτό δημιουργεί ένα διαχωρισμό φορτίου, με το ένα άκρο του μορίου να είναι ελαφρώς θετικό (δ+) και το άλλο άκρο ελαφρώς αρνητικό (δ-).
* Διαφορά στην ηλεκτροαρνητικότητα: Αυτή η ανομοιογενής κατανομή συμβαίνει λόγω των διαφορών στην ηλεκτροαρνητικότητα μεταξύ των ατόμων που εμπλέκονται στον δεσμό. Η ηλεκτροαρνητικότητα είναι η ικανότητα ενός ατόμου να προσελκύει ηλεκτρόνια προς τον εαυτό του.
* Διπολική στιγμή: Τα πολικά μόρια έχουν μια μόνιμη διπολική στιγμή, η οποία είναι ένα μέτρο του διαχωρισμού του φορτίου μέσα στο μόριο.
* Παραδείγματα: Νερό (H₂O), αμμωνία (NH₃), υδρογόνο χλωριούχο (HCl)
Μη πολικά μόρια
* Ακόμη και η κατανομή των ηλεκτρονίων: Σε μη πολωτικά μόρια, τα ηλεκτρόνια μοιράζονται εξίσου μεταξύ των ατόμων. Αυτό δεν έχει ως αποτέλεσμα τον συνολικό διαχωρισμό φορτίου μέσα στο μόριο.
* Παρόμοια ηλεκτροαρνητικότητα: Τα άτομα που εμπλέκονται στον δεσμό έχουν παρόμοιες τιμές ηλεκτροαρνητικότητας, επομένως τα ηλεκτρόνια προσελκύονται εξίσου.
* Χωρίς διπολική στιγμή: Τα μη πολωτικά μόρια δεν έχουν μόνιμη διπολική στιγμή.
* Παραδείγματα: Διοξείδιο του άνθρακα (CO₂), μεθάνιο (CH₄), οξυγόνο (O₂)
Βασικοί παράγοντες που επηρεάζουν την πολικότητα:
* Τύπος δεσμού:
* ομοιοπολικοί δεσμοί: Εάν η διαφορά ηλεκτροαρνητικότητας μεταξύ των ατόμων είναι σημαντική (0,4 έως 1,7), ο δεσμός είναι πολικός.
* Ιονικά ομόλογα: Αυτοί οι δεσμοί θεωρούνται ιδιαίτερα πολικοί λόγω της μεγάλης διαφοράς ηλεκτροαρνητικότητας.
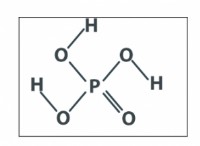
* Μοριακό σχήμα: Ακόμη και αν ένα μόριο έχει πολικούς δεσμούς, το συνολικό μόριο μπορεί να είναι μη πολικό εάν το σχήμα ακυρώσει τα δίπολα. Για παράδειγμα, το Co₂ έχει πολικούς δεσμούς, αλλά είναι ένα γραμμικό μόριο, έτσι ώστε τα δίπολα να ακυρώσουν.
Συνοπτικά:
Η διαφορά στην ηλεκτροαρνητικότητα μεταξύ των ατόμων σε ένα μόριο καθορίζει την πολικότητα του μορίου. Αυτή η διαφορά στην ηλεκτροαρνητικότητα οδηγεί σε ανομοιογενή κοινή χρήση ηλεκτρονίων, δημιουργώντας μια διπολική στιγμή. Τα μη πολωτικά μόρια έχουν παρόμοιες τιμές ηλεκτροαρνητικότητας, με αποτέλεσμα την ομοιόμορφη κατανομή των ηλεκτρονίων και χωρίς διπολική στιγμή.