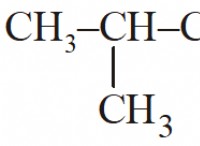7. Πόσα γραμμομορείς νερού μπορούν να παραχθούν με καύση 325 g οκτανίου (C8H18) σε υπερβολικό οξυγόνο.
1. Γράψτε την ισορροπημένη χημική εξίσωση:
2 C8H18 + 25 O2 → 16 CO2 + 18 H2O
2. Μετατροπή γραμμάρια οκτανίου σε moles:
* Μοριακή μάζα οκτανίου (C8H18) =8 (12,01 g/mol) + 18 (1,01 g/mol) =114,23 g/mol
* Moles Octane =(325 g) / (114,23 g / mol) =2,85 mol mol
3. Χρησιμοποιήστε την αναλογία mole από την ισορροπημένη εξίσωση:
* Η ισορροπημένη εξίσωση δείχνει ότι 2 γραμμομορείς οκτανίου παράγουν 18 γραμμομορείς νερού.
* Αναλογία mole του οκτανίου προς νερό:2 mol C8H18:18 mol H2O
4. Υπολογίστε τη μόρια του νερού που παράγεται:
* Moles νερού =(2,85 mol C8H18) * (18 mol H2O / 2 mol C8H18) =25,65 mol H2O
Επομένως, 25,65 γραμμομορείς νερού μπορούν να παραχθούν με καύση 325 g οκτανίου σε υπερβολικό οξυγόνο.