Τι είναι τα Αλκένια; Δομή και Αντιδράσεις Αλκενίων
Βασικές έννοιες
Αλκένια είναι από τα πιο κοινά και σημαντικά μόρια στην οργανική χημεία και τη βιοχημεία. Σε αυτό το άρθρο, θα μάθετε τη δομή του αλκενίου, την ονοματολογία του και μερικές από τις αντιδράσεις του.
Θέματα που καλύπτονται σε άλλα άρθρα
- Τι είναι τα Αλκίνια;
- Δομικά Ισομερή
- Γεωμετρικός ισομερισμός
- Αντίδραση E1
- Αντίδραση E2
Δομή αλκενίου
Τα αλκένια είναι υδρογονάνθρακες (ενώσεις που αποτελούνται εξ ολοκλήρου από άνθρακα και υδρογόνο) που περιέχουν διπλό δεσμό άνθρακα-άνθρακα (C=C, όπου ο ένας δεσμός είναι δεσμός σίγμα και ο άλλος δεσμός π). Ο διπλός δεσμός άνθρακα-άνθρακα είναι η λειτουργική ομάδα ενός αλκενίου.
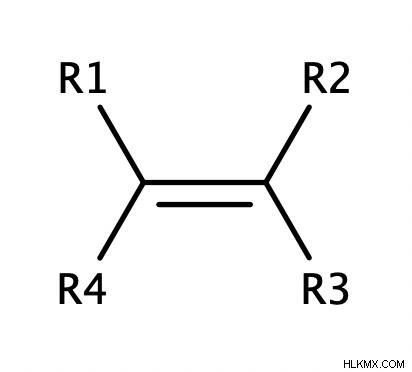

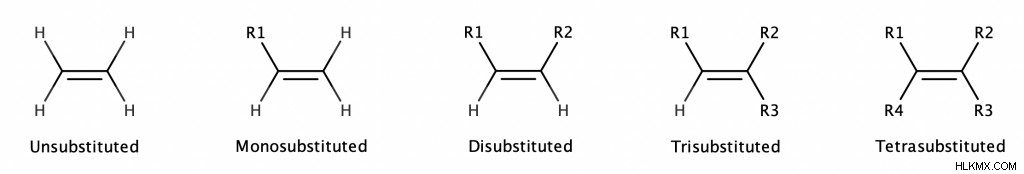
Ένα αλκένιο λέγεται ότι είναι υποκατεστημένο όταν τα άτομα υδρογόνου σε κάθε άκρο του δεσμού C=C αντικαθίστανται από ομάδες αλκυλίου (ή αλκυλαλογονιδίου).
Γρήγορα στοιχεία για τα αλκένια
- Δομή:Ένας άνθρακας διπλός συνδεδεμένος με έναν άλλο άνθρακα.

- Γενικός τύπος:Cn H2n , όπου n ≥ 2
- Οξύτητα:Πιο όξινη από τα αλκάνια
- Διαλυτότητα:Αδιάλυτο στο νερό αλλά διαλυτό σε μη πολικούς οργανικούς διαλύτες όπως ο διαιθυλαιθέρας
- Μήκος δεσμού C=C:1,33 Å
- Ισχύς δεσμού C=C:636 kJ mol
- Φασματοσκοπία IR:Αλκένια που διαθέτουν Csp –Ο δεσμός H (δηλαδή τυχόν αλκένια που δεν είναι τετραυποκατεστημένα) θα έχει κορυφή στα 3100 cm
Στερεοχημεία αλκενίων
Έχουμε καλύψει αυτή την έννοια εκτενώς σε αυτά τα άρθρα:Δομικά Ισομερή, Γεωμετρικός Ισομερισμός, Cis Trans Ισομερή, Στερεοϊσομερή και Χειρικά Κέντρα.
Έτσι, οι παρακάτω πληροφορίες θα είναι απλώς μια σύντομη ανανέωση.
Λόγω της ακαμψίας του διπλού δεσμού (την ανικανότητά του να περιστρέφεται), τα υποκατεστημένα αλκένια (δηλαδή τα αλκένια όπου τα άτομα υδρογόνου σε κάθε άκρο του δεσμού C=C αντικαθίστανται από μη-υδρογόνου υποκαταστάτες) μπορούν να υπάρχουν ως ζεύγος στερεοϊσομερών. Οι χημικοί χρησιμοποιούν ορολογία cis/trans ή E/Z για να περιγράψουν αυτά τα στερεοϊσομερή.
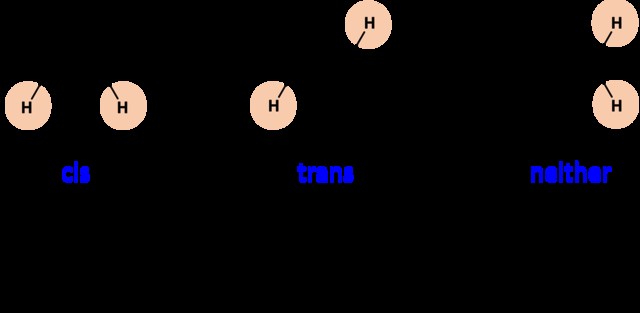
Cis/Trans
Οι χημικοί χρησιμοποιούν την ορολογία cis/trans για τα διυποκατεστημένα αλκένια, όπου οι υποκαταστάτες συνδέονται με διαφορετικά άκρα του δεσμού C=C.
- Τα ισομερή cis έχουν την ίδια ομάδα στην ίδια πλευρά του διπλού δεσμού.
- Τα trans ισομερή έχουν την ίδια ομάδα στις απέναντι πλευρές του διπλού δεσμού.
E/Z
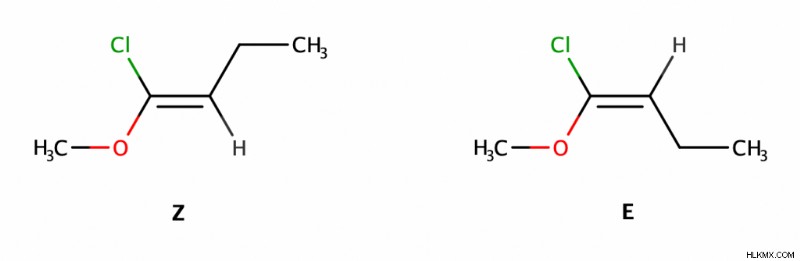
Οι χημικοί χρησιμοποιούν την ορολογία Ε/Ζ για τριυποκατεστημένα ή τετραυποκατεστημένα αλκένια.
Για να χρησιμοποιήσουμε την ορολογία E/Z, εκχωρούμε πρώτα προτεραιότητα στους υποκαταστάτες χρησιμοποιώντας τους κανόνες Cahn-Ingold-Prelog (όσο μεγαλύτερος είναι ο ατομικός αριθμός των στοιχείων στον υποκαταστάτη, τόσο μεγαλύτερη είναι η προτεραιότητα). Στη συνέχεια στρέφουμε την προσοχή μας σε κάθε άκρο του δεσμού C=C και συγκρίνουμε την προτεραιότητα του ζεύγους των υποκαταστατών εκεί μεταξύ τους.
- Τα ισομερή Ε έχουν υποκαταστάτες με μεγαλύτερη προτεραιότητα στις απέναντι πλευρές του διπλού δεσμού.
- Τα ισομερή Ζ έχουν υποκαταστάτες με υψηλότερη προτεραιότητα στην ίδια πλευρά του διπλού δεσμού.
Ονοματολογία αλκενίου
Για να ονομάσουμε ένα αλκένιο (καθαρό αλκένιο, χωρίς άλλες λειτουργικές ομάδες), προσδιορίζουμε πρώτα τον γονέα, που είναι η μεγαλύτερη αλυσίδα που περιέχει τον διπλό δεσμό C=C. Στη συνέχεια, εκχωρούμε έναν αριθμό στον διπλό δεσμό και σε άλλους υποκαταστάτες (αν υπάρχουν) για να υποδείξουμε τη θέση τους μέσα στο μόριο. Θα πρέπει να αντιστοιχίσουμε στον διπλό δεσμό τον μικρότερο δυνατό αριθμό. Τέλος, επισυνάπτουμε το επίθημα «ene» στο τέλος του ονόματος του μορίου μας. Πρέπει επίσης να βάλουμε "cis", "trans", "E" ή "Z" στο μπροστινό μέρος του ονόματος του μορίου μας, εάν είναι απαραίτητο.
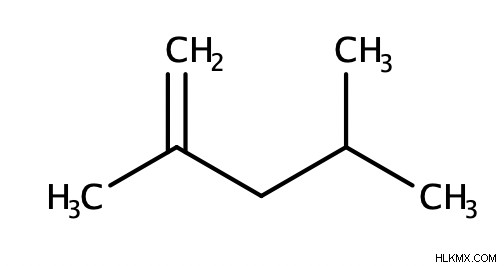
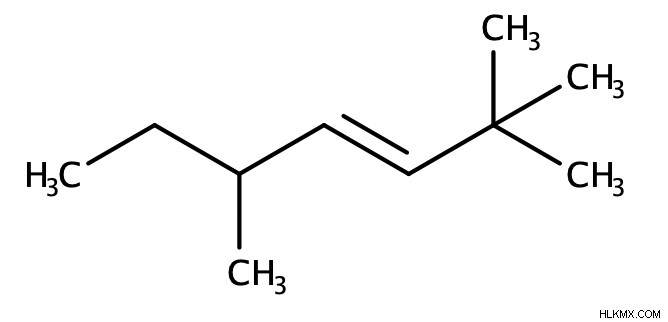
Επιπλέον, εάν ένα αλκένιο πάρει τη μορφή κυκλικού μορίου, τότε θα βάζαμε έναν «κυκλο» μπροστά από τη μητρική αλυσίδα.
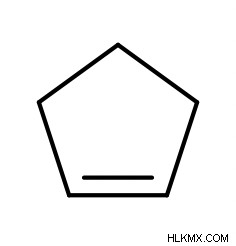
Η IUPAC αναγνωρίζει επίσης ορισμένες κοινές ονομασίες για κοινά αλκένια:αιθυλένιο, προπυλένιο, στυρόλιο κ.λπ.
Εάν το αλκένιο είναι απλώς ένας υποκαταστάτης ενός μορίου (δηλαδή υπάρχουν λειτουργικές ομάδες υψηλότερης προτεραιότητας), τότε θα βάλουμε ένα "en" μεταξύ της μητρικής αλυσίδας και της λειτουργικής ομάδας. Πρέπει επίσης να θυμόμαστε να βάλουμε έναν αριθμό μπροστά από το "en" για να υποδείξουμε τη θέση (μόνο αυτή τη φορά ο διπλός δεσμός δεν παίρνει τον μικρότερο δυνατό αριθμό) και οποιαδήποτε ένδειξη στερεοϊσομερισμού στο μπροστινό μέρος του ονόματος του μορίου, εάν είναι απαραίτητο.
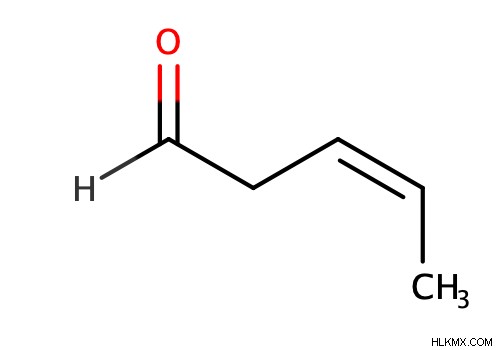
Αντιδράσεις αλκενίου
Γενικές τάσεις αντίδρασης
Οι χημικοί χρησιμοποιούν συχνά αλκένια ως δομικά στοιχεία για τη σύνθεση άλλων πολύπλοκων μορίων. Αυτό συμβαίνει επειδή τα αλκένια υφίστανται εύκολα αντιδράσεις προσθήκης. Δεδομένου ότι οι διπλοί δεσμοί C=C των αλκενίων είναι πλούσιοι σε ηλεκτρόνια, μπορούν να λειτουργήσουν ως βάσεις ή πυρηνόφιλα.
Αντιδράσεις εξάλειψης
Οι χημικοί χρησιμοποιούν αντιδράσεις απομάκρυνσης για να σχηματίσουν αλκένια. Έχουμε καλύψει τις αντιδράσεις αποβολής λεπτομερώς σε αυτά τα άρθρα:Αντιδράσεις E2, Αντιδράσεις E1, Κατανόηση των αντιδράσεων E1 έναντι E2.
Αντίδραση E2
Σε μια αντίδραση Ε2, η βάση Lewis αρπάζει ένα β-υδρογόνο και η αποχωρούσα ομάδα φεύγει ταυτόχρονα. Αυτό έχει ως αποτέλεσμα ο προσωρινός αρνητικά φορτισμένος άνθρακας να μοιράζεται τα ηλεκτρόνια του με το προσωρινό καρβοκατιόν για να σχηματίσει έναν διπλό δεσμό.
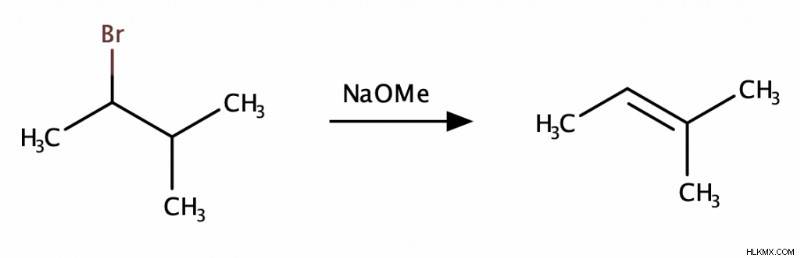
Αντίδραση E1
Η αντίδραση Ε1 είναι παρόμοια με την αντίδραση Ε2. Η κύρια διαφορά είναι ότι στην αντίδραση Ε1, η αποχωρούσα ομάδα φεύγει πρώτη, σχηματίζοντας ένα καρβοκατιόν. Μετά ερχόταν η βάση και έπιανε ένα βήτα-υδρογόνο.
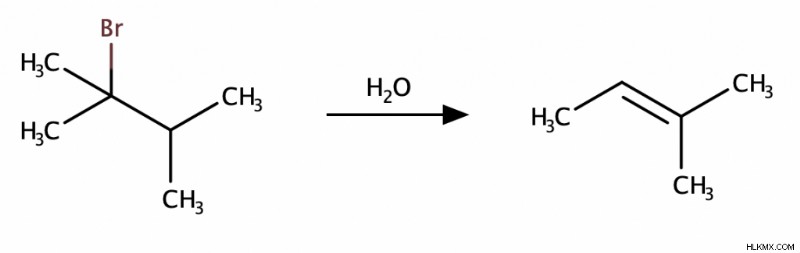
Αντιδράσεις προσθήκης
Στερεοχημεία και Τοποχημεία
Πριν εξετάσετε τις αντιδράσεις προσθήκης των αλκενίων, σας προτείνουμε να εξοικειωθείτε με την ορολογία που χρησιμοποιούν οι χημικοί για να περιγράψουν τη στερεοχημεία και τη τοποχημεία μιας αντίδρασης.
- Στερεοχημεία:προσθήκη συν, αντι προσθήκη
- Τοποχημεία:προσθήκη Markovnikov και προσθήκη anti-Markovnikov
Υδρογόνωση αλκενίων
Στην υδρογόνωση των αλκενίων, δύο άτομα υδρογόνου (Η) προστίθενται κατά μήκος του διπλού δεσμού C=C με τη βοήθεια ενός μεταλλικού καταλύτη όπως Pt, Pd ή Ni. Αυτή η αντίδραση είναι μια σύν προσθήκη.
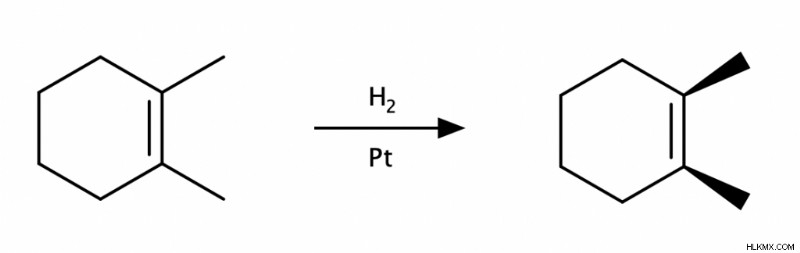
Υδροαλογόνωση αλκενίων
Στην υδροαλογόνωση των αλκενίων, ένα άτομο Η και ένα άτομο αλογόνου προστίθενται κατά μήκος του διπλού δεσμού C=C. Αυτή η αντίδραση είναι μιαMarkovnikov προσθήκη, και δίνει ένα μείγμα syn και αντι προϊόντα.
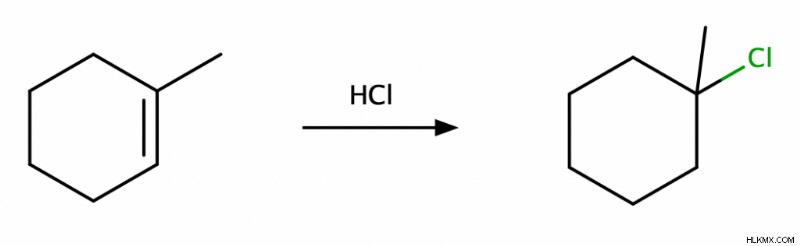
Ωστόσο, ένα περίεργο πράγμα συμβαίνει όταν προσθέτουμε HBr σε ένα αλκένιο παρουσία υπεροξειδίων (ROOR). Το προϊόν εξακολουθεί να είναι ένα μείγμα syn και αντι , αλλά η αντίδραση γίνεται αντι-Μαρκόβνικοφ Επιπλέον, όπου το Br καταλήγει στον λιγότερο υποκατεστημένο άνθρακα.
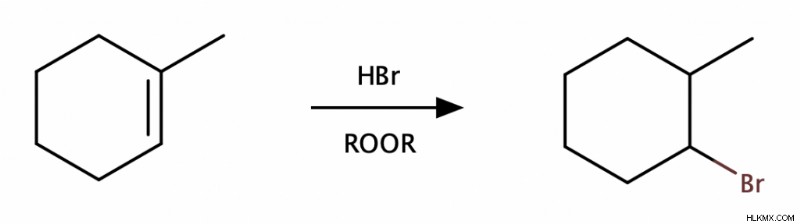
Ενυδάτωση Αλκενίων
Στην ενυδάτωση των αλκενίων, ένα άτομο Η και ένα μόριο ΟΗ προστίθενται κατά μήκος του διπλού δεσμού C=C. Αυτή η αντίδραση μπορεί να είναι Markovnikov ή anti-Markovnikov, ανάλογα με τα αντιδραστήρια μας.
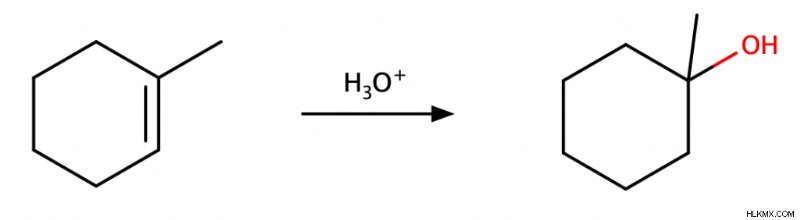
Ενυδάτωση καταλυόμενη από οξύ
Όπως υποδηλώνει το όνομά της, αυτή η αντίδραση περιλαμβάνει την προσθήκη νερού σε ένα αλκένιο παρουσία ενός οξέος. Αυτή η αντίδραση είναι Markovnikov και δίνει και τα δύο syn και αντι προϊόντα.
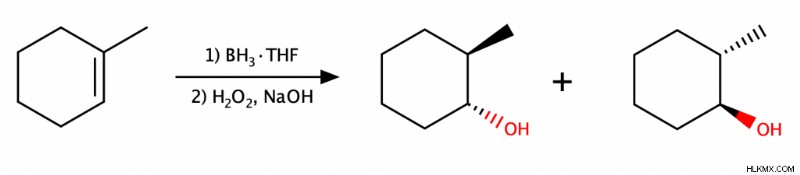
Υδροβορίωση–Οξείδωση
Αυτή η αντίδραση ενυδάτωσης περιλαμβάνει δύο στάδια. Το πρώτο βήμα, η υδροβορίωση, είναι η προσθήκη βορανίου (BH3 ) με έναν σταθεροποιητικό διαλύτη όπως το τετραϋδροφουράνιο (THF) στο αλκένιο. Το δεύτερο βήμα, η οξείδωση, είναι η προσθήκη υπεροξειδίου του υδρογόνου (H2 O2 ) και μια πηγή υδροξειδίου (ΟΗ) όπως νερό ή NaOH. Αυτή η αντίδραση είναι αντι-Μαρκόβνικοφ και δίνει μόνο syn προϊόντα.
Διυδροξυλίωση Αλκενίων
Στη διυδροξυλίωση των αλκενίων, προστίθενται δύο μόρια ΟΗ κατά μήκος του διπλού δεσμού C=C, μετατρέποντας αποτελεσματικά το αλκένιο σε διόλη. Εφόσον προσθέτουμε το ίδιο πράγμα (δηλαδή ΟΗ) και στους δύο άνθρακες, η τοποχημεία είναι άσχετη. Αντίθετα, η στερεοχημεία είναι ένα θέμα με μεγάλο ενδιαφέρον. Η αντίδραση μπορεί να είναι syn ή anti, ανάλογα με τα αντιδραστήρια μας.
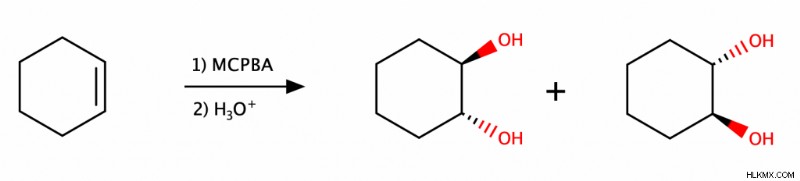
Αντιδιυδροξυλίωση
Για να πετύχετε ένααντι διυδροξυλίωση ενός αλκενίου, οι χημικοί επεξεργάζονται αυτό το αλκένιο πρώτα με υπεροξυοξέα (όπως το MCPBA) και στη συνέχεια με νερό υπό συνθήκες καταλυόμενες από οξύ. Το υπεροξυ οξύ μετατρέπει το αλκένιο σε εποξείδιο και το νερό ανοίγει το εν λόγω εποξείδιο.
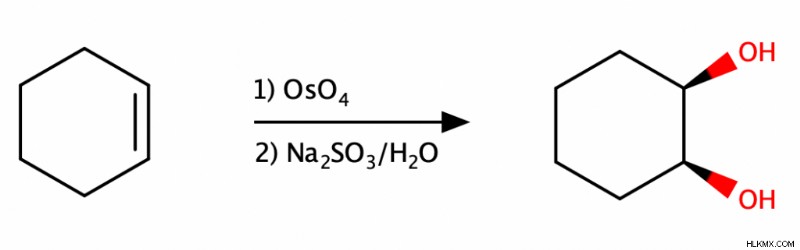
Συν Διυδροξυλίωση
Για να επιτύχετε ένα σύν διυδροξυλίωση ενός αλκενίου, οι χημικοί επεξεργάζονται αυτό το αλκένιο πρώτα με τετροξείδιο του οσμίου (OsO4 ) και στη συνέχεια με υδατικό θειούχο νάτριο (Na2 SO3 ) ή υδατικό όξινο θειούχο νάτριο (NaHSO3 ).
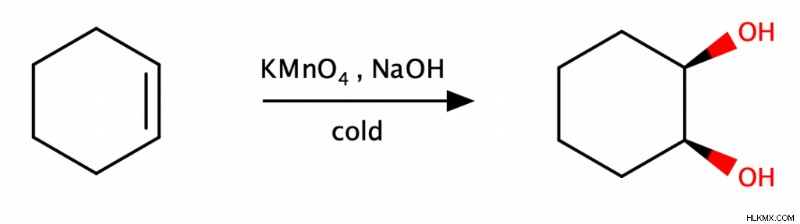
Μια άλλη μέθοδος είναι η επεξεργασία του αλκενίου με ψυχρό υπερμαγγανικό κάλιο (KMnO4 ) και μια πηγή υδροξειδίου.
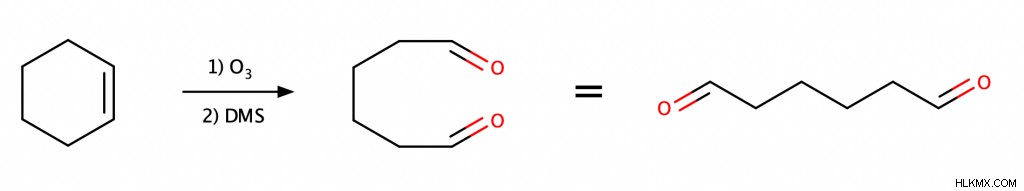
Οζονόλυση
Η οζονόλυση είναι μία από τις πολλές αντιδράσεις που χρησιμοποιούν οι χημικοί για να διασπάσουν τον δεσμό C=C. Για να πραγματοποιήσουν οζονόλυση, οι χημικοί διοχετεύουν πρώτα το όζον στο διάλυμα αλκενίου και στη συνέχεια προσθέτουν στο διάλυμα έναν αναγωγικό παράγοντα όπως το διμεθυλοσουλφίδιο (DMS). Το αποτέλεσμα είναι ένας δεσμός C=C που χωρίζεται σε δύο δεσμούς C=O.
Περισσότερες αναγνώσεις
- Λειτουργική ομάδα Amino
- Λειτουργική ομάδα καρβονυλίου
- Λειτουργική ομάδα καρβοξυλικού οξέος
- Ταυτομερισμός κετοενόλης
- Αντίδραση συμπύκνωσης Aldol
- Αντίδραση Diels-Alder




