Η επιστήμη πίσω από το μαγείρεμα των σιροπιών ζάχαρης για την παρασκευή καραμελών
Η παρασκευή καραμέλας περιγράφεται συχνά ως επιστήμη, που απαιτεί θερμόμετρα για να βράσουν αυτό το σιρόπι ζάχαρης στην ακριβή σωστή θερμοκρασία. Εναλλακτικά, μπορείτε να μαγειρέψετε το σιρόπι σε ένα προδιαγεγραμμένο στάδιο, «μαγειρέψτε σε σκληρό κρακ», το οποίο μπορεί να είναι τρομακτικό. Αν δεν ακολουθήσετε τις λεπτομερείς οδηγίες η καραμέλα, τα marshmallows, η κηρήθρα ή σχεδόν οποιοδήποτε άλλο ζαχαρωτά σας είναι καταδικασμένα να αποτύχουν (ή τουλάχιστον, έτσι νιώθετε). Ή μπορεί να κάνατε το αντίθετο και απλώς να μαντέψατε τον δρόμο σας. Διακινδυνεύετε η καραμέλα σας να είναι λίγο πολύ σκληρή και η κηρήθρα σας πολύ μαστιχωτή.
Αν και σίγουρα υπάρχει τέχνη στην παρασκευή καραμέλας, υπάρχει επίσης πολλή επιστήμη σε αυτό, εξ ου και οι λεπτομερείς οδηγίες. Σε προηγούμενο άρθρο, σας δείξαμε πώς τα σιρόπια ζάχαρης αλλάζουν σύσταση όταν τα μαγειρεύετε. Εδώ, θα εμβαθύνουμε στην επιστήμη πίσω από όλες αυτές τις οδηγίες.
Παραλλαγή ζαχαρωτού
Είναι απίστευτο πώς χρησιμοποιώντας ένα βασικό συστατικό, τη ζάχαρη, μπορείτε να φτιάξετε τόσα πολλά διαφορετικά είδη καραμέλας. Το αφράτο μαλλί της γριάς, η αέρινη κηρήθρα, το τραγανό φιστίκι, οι λαστιχωτές καραμέλες, τα μαλακά marshmallows και το τραγανό καραμέλα είναι όλα χτισμένα πάνω στη ζάχαρη, αλλά εξακολουθούν να είναι πολύ διαφορετικά. Μερικά είναι ελαφριά και ευάερα, άλλα πυκνά και τραγανά.
Πρέπει να ευχαριστήσουμε τον συναρπαστικό τρόπο με τον οποίο η ζάχαρη αλληλεπιδρά με το νερό για αυτό το ευρύ φάσμα υφών! Όλα αυτά τα στυλ καραμέλας περιλαμβάνουν την παρασκευή ενός διαλύματος ζάχαρης σε νερό, ακριβώς πόση ζάχαρη σε πόση (ή λίγο) νερό, καθορίζει σε μεγάλο βαθμό τη συμπεριφορά της καραμέλας!
Αν και τα περισσότερα ζαχαρωτά περιέχουν άλλα συστατικά όπως λίπη, διογκωτικούς παράγοντες ή πρωτεΐνες, προς το παρόν, θα υποθέσουμε ότι αυτές οι καραμέλες είναι απλώς ζάχαρη και νερό. Θα μας βοηθήσει να εξηγήσουμε την επιστήμη, χωρίς πάρα πολλούς περισπασμούς.



3 βασικές επιστημονικές έννοιες καραμέλας ζάχαρης
Για να εξηγήσουμε και να κατανοήσουμε πώς συμπεριφέρονται τα διαλύματα ζάχαρης και φτιάχνουν αυτούς τους διαφορετικούς τύπους καραμέλας, πρέπει να εμβαθύνουμε στην επιστήμη των διαλυμάτων ζάχαρης. Τρεις έννοιες είναι ιδιαίτερα σημαντικές εδώ, που αποτελούν τη βάση των περισσότερων επιστημών παρασκευής ζαχαρωτών:
- Υψόμετρο σημείου βρασμού
- Διαλυτότητα
- Γυάλινη μετάβαση
Υψόμετρο σημείου βρασμού
Στο επίπεδο της θάλασσας, το καθαρό νερό έχει σημείο βρασμού 100°C (212°F) και σημείο πήξης 0°C (32°F). Ωστόσο, μπορείτε να αλλάξετε αυτό το σημείο βρασμού και το σημείο πήξης διαλύοντας άλλα συστατικά σε νερό όπως αλάτι ή ζάχαρη. Οι αλληλεπιδράσεις μεταξύ των διαφορετικών συστατικών επηρεάζουν το πόσο εύκολα βράζει ή παγώνει το υγρό. Το πόσο αλλάζει το σημείο βρασμού ή πήξης εξαρτάται από το πόσο από αυτό το πρόσθετο συστατικό (π.χ. ζάχαρη) έχει διαλυθεί στο υγρό.
Μπορείτε να διαλύσετε πολλά μόρια ζάχαρης στο νερό, έχει υψηλή διαλυτότητα. Ως εκ τούτου, μπορείτε να επηρεάσετε σε μεγάλο βαθμό το σημείο βρασμού και πήξης του νερού. Το τελευταίο το χρησιμοποιείτε όταν φτιάχνετε παγωτό. Η προσθήκη ζάχαρης στο παγωτό σας θα μειώσει το σημείο πήξης αυτού του παγωτού. Είναι αυτό που κάνει το παγωτό σας απαλό, παρόλο που είναι παγωμένο σε θερμοκρασίες πολύ κάτω από τους 0°C.
Το αλάτι στους δρόμους το χειμώνα βασίζεται επίσης στην έννοια της κατάθλιψης του σημείου παγώματος. Οι υψηλές συγκεντρώσεις αλατιού μειώνουν το σημείο πήξης του νερού, εμποδίζοντάς το να παγώσει στο δρόμο!
Όταν φτιάχνετε γλυκά, από την άλλη πλευρά, χρησιμοποιείτε την ανύψωση του σημείου βρασμού. Όσο περισσότερη ζάχαρη διαλύετε, τόσο υψηλότερο γίνεται το σημείο βρασμού αυτού του διαλύματος ζάχαρης. Ένα διάλυμα ζάχαρης με 60% ζάχαρη (σακχαρόζη) έχει ήδη σημείο βρασμού περίπου 103°C (217°F). Επιπλέον, αυξήστε αυτή τη συγκέντρωση στο 90% και το σημείο βρασμού είναι πιο κοντά στους 120°C (248°F)! Όσο παραμένετε στο ίδιο υψόμετρο και χρησιμοποιείτε τα ίδια σάκχαρα, υπάρχει μια σταθερή σχέση μεταξύ της συγκέντρωσης ενός διαλύματος ζάχαρης και του σημείου βρασμού του.

Διαλυτότητα
Όπως αναφέραμε γρήγορα παραπάνω, η ζάχαρη διαλύεται εύκολα στο νερό. Ακόμη και σε θερμοκρασία δωματίου, μπορείτε να διαλύσετε το διπλάσιο βάρος της ζάχαρης σε νερό (περίπου 210 g ανά 100 ml). Μπορείτε να διαλύσετε ακόμη περισσότερη ζάχαρη στο νερό αυξάνοντας τη θερμοκρασία του διαλύματός σας. Όχι μόνο θα διαλυθεί περισσότερη ζάχαρη, αλλά θα διαλυθεί και πιο γρήγορα. Μια κουταλιά ζάχαρης διαλύεται σχεδόν αμέσως όταν προστεθεί σε ένα φλιτζάνι ζεστό τσάι, ενώ η ίδια ποσότητα θα χρειαστεί λίγο χρόνο για να διαλυθεί σε ένα κρύο ποτήρι νερό.
Συνδυάζοντας την έννοια της «ανύψωσης του σημείου βρασμού» και της αυξανόμενης διαλυτότητας της ζάχαρης σε θερμότερο νερό, μπορείτε να δημιουργήσετε διαλύματα ζάχαρης υψηλής συγκέντρωσης. Απλώς βάλτε ένα διάλυμα ζάχαρης να βράσει. Με αυτόν τον τρόπο θα εξατμίσετε το νερό. Ως αποτέλεσμα, η συγκέντρωση της ζάχαρης αυξάνεται, η οποία και πάλι αυξάνει το σημείο βρασμού, εξατμίζοντας ακόμη περισσότερο νερό. Μπορείτε να συμπυκνώσετε διαλύματα ζάχαρης μέχρι να γίνουν σχεδόν 100% ζάχαρη!
Κορεσμός διαλύματος
Παρόλο που μπορείτε να διαλύσετε πολλή ζάχαρη σε ζεστό νερό, μόλις κρυώσετε ξανά το διάλυμα, η διαλυτότητα θα επιστρέψει στην αρχική του τιμή. Αυτό είναι που οι επιστήμονες αποκαλούν υπερκορεσμένο διάλυμα, περισσότερη ζάχαρη διαλύεται παρά είναι ενεργειακά σταθερή. Με την πάροδο του χρόνου, η ζάχαρη θα κρυσταλλωθεί από το διάλυμα, κάτι που είναι απλώς πιο ευνοϊκό. Ως αποτέλεσμα, θα καταλήξετε με κρυστάλλους ζάχαρης &διάλυμα ζάχαρης.
Ο τρόπος με τον οποίο προκαλείτε και ελέγχετε την κρυστάλλωση αυτής της «υπερβάλλουσας» ζάχαρης είναι μια βασική τεχνική της παρασκευής ζαχαρωτών. Πολλές καραμέλες όπως φοντάν ή κρέμες χρειάζονται λίγη ζάχαρη για να ξανακρυσταλλωθούν. Η κρυσταλλική ζάχαρη δίνει στις καραμέλες σφριγηλότητα αλλά και πολύ ωραίες ιδιότητες τήξης.
Χρησιμοποιείτε την έννοια του υπερκορεσμού ενός διαλύματος για πολλές καραμέλες, συμπεριλαμβανομένης της ζάχαρης!

Γυάλινη μετάβαση
Δεν μπορεί σε όλες τις περιπτώσεις η ζάχαρη να ανακρυσταλλωθεί ξανά αφού συμπυκνωθεί σε νερό. Συμπυκνώνοντας ένα διάλυμα ζάχαρης και μειώνοντας την περιεκτικότητα σε νερό δημιουργείτε ένα παχύρρευστο και παχύρρευστο υλικό (δείτε φωτογραφίες από διαφορετικά στάδια μαγειρέματος σιροπιού ζάχαρης εδώ). Το διάλυμα μπορεί να γίνει τόσο εξαιρετικά παχύρρευστο και παχύ που τα μόρια δυσκολεύονται πολύ να μετακινηθούν. Κάποια στιγμή τα μόρια «κολλάνε». Παρόλο που μιλώντας ενεργειακά, είναι πιο αποτελεσματικό να κρυσταλλώνεται ένας κρύσταλλος ζάχαρης, απλά δεν μπορεί να κινηθεί αρκετά ώστε να οργανωθεί σε κρύσταλλο!
Οι συνθήκες κάτω από τις οποίες συμβαίνει αυτό, ότι ένα διάλυμα είναι απλώς πολύ συμπυκνωμένο και παχύρρευστο για να κρυσταλλωθεί και να ρέει ονομάζονται μετάπτωση υάλου. Το διάλυμα ζάχαρης θα σχηματίσει κυριολεκτικά ένα ποτήρι!
Διάγραμμα κατάστασης:σχεδίαση των 3 εννοιών σε ένα γράφημα
Αυτές οι τρεις βασικές έννοιες αποτελούν τη βάση της παρασκευής ζαχαρωτών. Συνδυάζοντάς τα σε μία απεικόνιση, μπορείτε να προβλέψετε ακριβώς πώς θα συμπεριφέρεται το ζαχαρούχο διάλυμα και τι είδους καραμέλα μπορείτε να φτιάξετε. Οι επιστήμονες το κάνουν αυτό χρησιμοποιώντας ένα διάγραμμα κατάστασης (χρησιμοποιήσαμε κάτι παρόμοιο όταν συζητήσαμε την επιστήμη του παγωτού), το οποίο θα εξετάσουμε εδώ.
The Axes:Temperature &Concentration
Ξεκινάμε το διάγραμμα σχεδιάζοντας δύο άξονες, τον άξονα x και y. Σε αυτούς τους δύο άξονες σχεδιάζουμε τις δύο συνθήκες που καθορίζουν πώς θα συμπεριφέρεται ένα διάλυμα ζάχαρης:
- άξονας x:η συγκέντρωση της ζάχαρης στο διάλυμα ζάχαρης
- άξονας y:η θερμοκρασία
Σε συνδυασμό, αυτοί οι δύο παράγοντες μπορούν να προβλέψουν πώς θα συμπεριφερθεί τελικά ένα διάλυμα ζάχαρης. Όπως μπορείτε να φανταστείτε, ένα ζεστό διάλυμα ζάχαρης με συγκέντρωση Α μπορεί να συμπεριφέρεται πολύ διαφορετικά από το ίδιο διάλυμα σε θερμοκρασία δωματίου. Το ίδιο για διαλύματα στην ίδια θερμοκρασία αλλά με διαφορετικές συγκεντρώσεις.
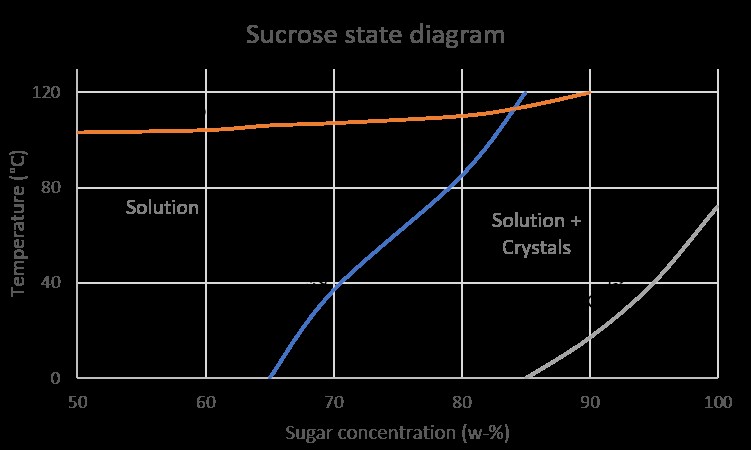
Σχεδιάζοντας τις έννοιες
Στη συνέχεια, οι επιστήμονες θα θέλουν να προσθέσουν τις τρεις βασικές έννοιες που μόλις συζητήσαμε:ανύψωση σημείου βρασμού, διαλυτότητα και μετάβαση γυαλιού στο διάγραμμα. Είναι πραγματικά εκπληκτικά δύσκολο να ληφθούν καλά, ακριβή δεδομένα για αυτά τα τρία φαινόμενα. Μπορεί να χρειαστούν τόνοι πειραμάτων στους επιστήμονες για να προσδιορίσουν το ακριβές σημείο βρασμού ενός διαλύματος ή την πραγματική διαλυτότητα.
Στο γράφημα πάνω από την πορτοκαλί γραμμή στην κορυφή αντιπροσωπεύει το υψόμετρο του σημείου βρασμού. Μπορείτε να δείτε πώς η αύξηση της συγκέντρωσης της ζάχαρης, αυξάνει σιγά σιγά το σημείο βρασμού του διαλύματος. Το χαμηλότερο σημείο είναι 100°C (212°F) που είναι το σημείο βρασμού του καθαρού νερού, άρα με 0% σακχαρόζη.
Η μεσαία μπλε γραμμή αντιπροσωπεύει τη διαλυτότητα της ζάχαρης. Παρατηρήστε εδώ ότι όσο αυξάνεται η θερμοκρασία, αυξάνεται και η διαλυτότητα. Αυτό συμφωνεί με αυτό που συζητήσαμε προηγουμένως.
Τέλος, παρατηρήστε τη γραμμή που υποδεικνύει τη μετάβαση γυαλιού. Οποιοδήποτε σημείο κάτω από αυτή τη γκρίζα γραμμή πιθανότατα θα μετατραπεί σε ποτήρι. Παρατηρήστε πώς σχηματίζονται ποτήρια μόνο για πολύ υψηλές συγκεντρώσεις ζάχαρης και σε μέτριες θερμοκρασίες. Είναι κάτω από αυτές τις συνθήκες που τα μόρια απλά δεν μπορούν να κινηθούν αρκετά καλά για να σχηματίσουν κρυστάλλους.
Μοναδικό για ζάχαρη (μίγμα)
Επίσης, να έχετε κατά νου ότι όλα αυτά τα φαινόμενα εξαρτώνται από το ποια ακριβώς ζάχαρη αξιολογείτε. Αυτές οι γραμμές θα βρίσκονται σε διαφορετικές συγκεντρώσεις και θερμοκρασίες για διαφορετικούς τύπους ζάχαρης ή ακόμα και μείγματα ζάχαρης.
Ενώ όλα αυτά είναι πολύ ωραία, έχετε κατά νου ότι η δημιουργία ενός τέτοιου διαγράμματος κατάστασης απαιτεί πολλά δεδομένα. Επιπλέον, ένα διάγραμμα ισχύει μόνο για μια συγκεκριμένη ζάχαρη ή μείγμα σακχάρων. Με άλλα λόγια, το διάγραμμα για τη σακχαρόζη θα είναι ελαφρώς διαφορετικό από αυτό της γλυκόζης, το οποίο και πάλι διαφέρει από αυτό της φρουκτόζης.
Αυτός είναι επίσης ο λόγος που η χρήση διαφορετικών σακχάρων κατά την παρασκευή της καραμέλας σας θα επηρεάσει ακριβώς το πώς βγαίνει αυτή η τελική καραμέλα.
Χρήση του διαγράμματος κατάστασης
Τώρα που γνωρίζουμε την επιστήμη πίσω από το διάγραμμα κατάστασης, ας δούμε πώς μπορούμε να το χρησιμοποιήσουμε όταν φτιάχνουμε καραμέλες. Θα σας καθοδηγήσουμε σε μερικά σενάρια.
Σιρόπια ζάχαρης

Για ορισμένες εφαρμογές, το μόνο που θέλετε να κάνετε είναι να διαλύσετε τη ζάχαρη σε νερό. Αυτό το σιρόπι πρέπει στη συνέχεια να είναι υγρό και να ρέει εύκολα. Σκεφτείτε ένα γλάσο που θα περιχύνατε πάνω σε ένα κέικ. Εάν θέλετε να αποθηκεύσετε αυτό το σιρόπι για περισσότερο, χωρίς να σχηματιστούν κρύσταλλοι, πρέπει να παραμείνουμε στα αριστερά της καμπύλης «διαλυτότητας» στο διάγραμμα κατάστασης.
Όσο η συγκέντρωση της ζάχαρης σας σε συνδυασμό με τη θερμοκρασία στην οποία την αποθηκεύετε (πιθανότατα θερμοκρασία δωματίου), παραμένει στα αριστερά αυτής της καμπύλης, θα πρέπει να είστε καλά. Αυτή είναι η περιοχή που έχει επισημανθεί ως "λύση".
Κοιτάζοντας το διάγραμμα στα δεξιά, ένα διάλυμα ζάχαρης με 50 ή 60% ζάχαρη σε θερμοκρασία δωματίου δεν θα κρυσταλλωθεί. Σε υψηλότερες θερμοκρασίες, π.χ. 80°C ακόμη και ένα διάλυμα 70% είναι σταθερό.
Δημιουργία κρυστάλλων
Υπάρχουν πολλές καραμέλες, όπως φοντάν και κρέμες, όπου θέλετε να κρυσταλλώσει λίγη από τη ζάχαρη. Τα μπισκότα Kurma είναι ένα άλλο καλό παράδειγμα αυτής της κατηγορίας, όπως και η ζάχαρη βράχου. Σε όλες τις περιπτώσεις, θέλετε να κρυσταλλωθεί η ζάχαρη για να δημιουργήσετε τη σωστή υφή και δομή.
Για να συμβεί αυτό πρέπει να φτιάξετε ένα διάλυμα που να βρίσκεται στην περιοχή μεταξύ της διαλυτότητας και της καμπύλης μετάπτωσης γυαλιού. Η περιοχή επισημαίνεται ως «διάλυμα + κρύσταλλα». Ένα διάλυμα ζάχαρης αυτής της σύνθεσης και θερμοκρασίας θα κρυσταλλωθεί με την πάροδο του χρόνου. Αν φτιάξετε ένα σιρόπι ζάχαρης σε θερμοκρασία δωματίου με 80w% ζάχαρη, θα έχετε φτιάξει ένα διάλυμα που κρυσταλλώνει.
Σχηματισμός ποτηριού
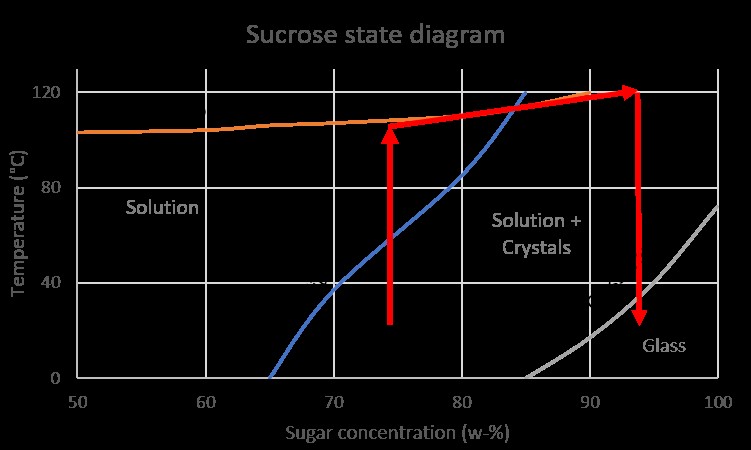
Τέλος, μπορεί να θέλετε να φτιάξετε μια καραμέλα που είναι πολύ τραγανή και τραγανή, η οποία κουμπώνει όταν προσπαθείτε να τη σπάσετε. Αυτό μπορεί να σας φέρει στη γυάλινη περιοχή. Θα θέλετε να φτιάξετε ένα διάλυμα ζάχαρης σε θερμοκρασία δωματίου που να περιέχει πάνω από 90w% ζάχαρη! Φυσικά, δεν μπορείτε να το κάνετε απλώς ανακατεύοντας νερό και ζάχαρη μαζί, η ζάχαρη δεν θα διαλυθεί. Αντίθετα, θα πρέπει πρώτα να φέρετε ένα διάλυμα ζάχαρης σε βρασμό, να το μαγειρέψετε στους περίπου 120°C (248°F) για να συμπυκνωθεί το διάλυμα, πριν το κρυώσετε σε θερμοκρασία δωματίου.
Μπορείτε να απεικονίσετε αυτή τη διαδικασία στο διάγραμμα κατάστασης που μόλις συζητήσαμε, χρησιμοποιώντας τα κόκκινα βέλη που εμφανίζονται. Παρατηρήστε πώς το 3ο βέλος διέρχεται από την περιοχή «λύση + κρύσταλλα». Εάν δεν κρυώσετε αυτό το είδος καραμέλας αρκετά γρήγορα, μπορεί να κρυσταλλωθεί σε αυτήν την περιοχή, καταστρέφοντας τη γυάλινη δομή σας!
Η πραγματικότητα είναι πιο περίπλοκη (δυστυχώς)
Παρόλο που οι βασικές έννοιες που συζητήσαμε ισχύουν όλες για τα ζαχαρωτά, στην πραγματικότητα είναι λίγο πιο περίπλοκο. Όπως αναφέραμε, το διάγραμμα κατάστασης που δείξαμε αφορά τη σακχαρόζη («κανονική» ζάχαρη). Ωστόσο, η σακχαρόζη δεν είναι εντελώς σταθερή σε υψηλότερες θερμοκρασίες. Όταν το μαγειρεύετε, μπορεί να διασπάτε λίγη από τη σακχαρόζη σε ιμβερτοποιημένο σάκχαρο. Το ιμβερτοποιημένο σάκχαρο συμπεριφέρεται ελαφρώς διαφορετικά από τη σακχαρόζη. Μια μεγάλη διαφορά είναι ότι δεν κρυσταλλώνεται τόσο εύκολα, επομένως μπορεί πραγματικά να αποτρέψει την κρυστάλλωση παρόλο που νομίζατε ότι βρίσκεστε στη ζώνη "λύση + κρύσταλλοι".
Και το ιμβερτοποιημένο σάκχαρο δεν είναι ο μόνος παράγοντας που παίζει. Η προσθήκη άλλων σιροπιών όπως το σιρόπι καλαμποκιού μπορεί επίσης να αποτρέψει την κρυστάλλωση της ζάχαρης από το να συμβεί εκεί που κανονικά θα γινόταν! Είναι ένα χαρακτηριστικό που χρησιμοποιούμε όταν φτιάχνουμε πολλούς διαφορετικούς τύπους καραμέλας, για παράδειγμα.
Τούτου λεχθέντος, ποτέ δεν είπαμε ότι η παρασκευή γλυκών ήταν εύκολη;-). Ωστόσο, χρησιμοποιήστε αυτό το κομμάτι της επιστημονικής κατανόησης για να σας βοηθήσει να προσαρμόσετε και να λύσετε το πρόβλημα της καραμέλας σας και θα προχωρήσετε πολύ. Έχουμε γράψει μερικούς οδηγούς που φέρνουν αυτή τη γνώση στον «πραγματικό» κόσμο για να σας βοηθήσουμε ακριβώς σε αυτό. Διαβάστε περισσότερα για τη ροκ ζάχαρη, την καραμέλα, τα σιρόπια ζάχαρης ή τα μπισκότα κρυσταλλωμένης ζάχαρης για να τα ζωντανέψετε όλα!





