Η επίσημη χρέωση του NO3- (Νιτρικά)

Το νιτρικό, χημικός τύπος NO3, έχει χημικό φορτίο -1. Τα νιτρικά ιόντα έχουν αρνητικό ένα τυπικό φορτίο. Ίσως αναρωτιέστε γιατί συμβαίνει αυτό. Γιατί η πλήρης φόρτιση του N03 δεν είναι -9;
Για να το κατανοήσουμε αυτό, ας ρίξουμε μια ματιά στον αριθμό των ατόμων σε ένα μόριο NO3 και ας καταλάβουμε πώς υπολογίζονται τα τυπικά φορτία.
Τι είναι μια επίσημη χρέωση;
Ένα τυπικό φορτίο, ή χημικό φορτίο, είναι το φορτίο που διαθέτει ένα άτομο σε ένα μόριο, υποθέτοντας ότι τα ηλεκτρόνια που βρίσκονται μέσα στους χημικούς δεσμούς μοιράζονται όλα εξίσου μεταξύ των ατόμων που αποτελούν το μόριο. Αυτό σημαίνει ότι η σχετική ηλεκτραρνητικότητα δεν αποτελεί παράγοντα.
Προκειμένου να υπολογιστεί ένα τυπικό φορτίο, τα ηλεκτρόνια εκχωρούνται σε μεμονωμένα άτομα εντός του μορίου με βάση δύο διαφορετικούς κανόνες:τα συνδετικά ηλεκτρόνια πρέπει να διαιρούνται εξίσου στα διαφορετικά συνδεδεμένα άτομα και τα μη συνδεδεμένα ηλεκτρόνια θεωρούνται μέρος του ατόμου στο οποίο βρίσκονται .
Η εξίσωση για τον προσδιορισμό της επίσημης χρέωσης μπορεί να περιγραφεί ως εξής:
Τυπική χρέωση =eV – eN – eB/2
Δεδομένου ότι:
- eV =Ο συνολικός αριθμός ηλεκτρονίων σθένους που διαθέτει το άτομο σαν να ήταν απομονωμένο από το υπόλοιπο μόριο.
- eN =Ο συνολικός αριθμός των μη δεσμευμένων ηλεκτρονίων σθένους που έχει το άτομο όταν τοποθετείται εντός του μορίου.
- eB =Ο συνολικός αριθμός ηλεκτρονίων που μοιράζονται οι δεσμοί που συνδέουν τα άτομα με άλλα άτομα εντός του μορίου.
Παραδείγματα επίσημης χρέωσης
Ας δούμε ένα παράδειγμα τυπικού υπολογισμού χρέωσης:
Το διοξείδιο του άνθρακα, το CO2, είναι ένα ουδέτερο μόριο που διαθέτει 16 ηλεκτρόνια στο κέλυφος σθένους του. Σχεδιάζοντας τη δομή Lewis του μορίου αποκαλύπτεται ότι μπορεί να σκιαγραφηθεί με τρεις διαφορετικούς τρόπους. Το άτομο άνθρακα θα μπορούσε ενδεχομένως να ενωθεί με τα άτομα οξυγόνου που το περιβάλλουν με διπλούς δεσμούς ή το άτομο άνθρακα θα μπορούσε να ενωθεί με ένα από τα άτομα οξυγόνου με διπλό δεσμό και με το άλλο άτομο οξυγόνου με έναν απλό δεσμό. Τέλος, το άτομο άνθρακα θα μπορούσε να ενωθεί και στα δύο άτομα οξυγόνου με απλούς δεσμούς.
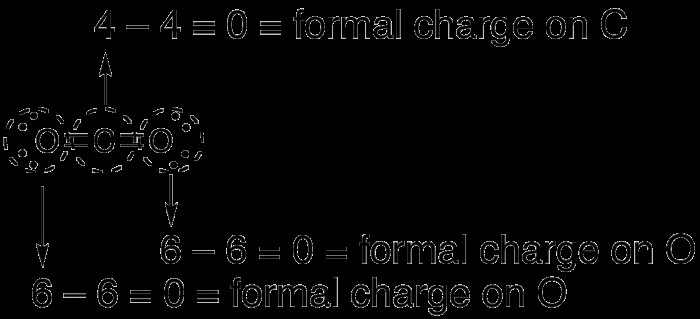
Παρατηρήστε ότι στην περίπτωση του διοξειδίου του άνθρακα, κάθε πιθανός σχηματισμός του μορίου έχει τυπικό φορτίο μηδέν. Στην πρώτη περίπτωση ο άνθρακας και το οξυγόνο έχουν μηδενικό φορτίο, με αποτέλεσμα μηδενικά συνολικά φορτία. Στη δεύτερη περίπτωση, ο άνθρακας έχει θετικό φορτίο 1 ενώ ο διπλός δεσμός οξυγόνου έχει φορτίο μηδέν και ο απλός δεσμός οξυγόνου έχει φορτίο -1 με αποτέλεσμα το καθαρό τυπικό φορτίο μηδέν. Ο άνθρακας έχει φορτίο +2, ενώ τα οξυγόνα έχουν φορτίο -1 το καθένα, με αποτέλεσμα πάλι ένα τυπικό φορτίο μηδέν.
Ας εξετάσουμε ένα άλλο παράδειγμα επίσημης χρέωσης.
Ποιο είναι το επίσημο φορτίο της ένωσης τετραϋδροβορικού, ή BH4; Το BH4 αποτελείται από βόριο και υδρογόνο, οπότε ας εξετάσουμε τους δεσμούς μεταξύ των δύο στοιχείων. Το BH4 δεν διαθέτει ηλεκτρόνια χωρίς δεσμό, τρία ηλεκτρόνια σθένους για το βόριο και τέσσερις δεσμούς γύρω από το άτομο του βορίου. Μεταφράζοντας αυτό σε μια αναπαράσταση του τυπικού τύπου χρέωσης, ο τύπος θα εκφραστεί ως 3 – ( 0 + 4) ή συνολικά -1.
Τώρα ας εξετάσουμε τα άτομα υδρογόνου στο μόριο. Όπως το βόριο, το υδρογόνο έχει μηδενικά μη δεσμευτικά ηλεκτρόνια, αλλά έχει μόνο ένα ηλεκτρόνιο σθένους και έναν απλό δεσμό. Αυτό σημαίνει ότι το τυπικό φορτίο του υδρογόνου εντός του BH4 είναι 1 – (0 + 1), που σημαίνει ότι το τυπικό φορτίο του υδρογόνου είναι μηδέν.
Τυπικές χρεώσεις και δομές Lewis
Οι δομές Lewis ονομάζονται επίσης δομές ηλεκτρονίων και είναι διαγράμματα που δείχνουν πιθανούς δεσμούς μεταξύ των ατόμων που αποτελούν ένα μόριο, καθώς και τυχόν ζεύγη ηλεκτρονίων που δεν είναι συνδεδεμένα. Οι γραμμές σε μια δομή Lewis σχεδιάζονται μεταξύ ατόμων και χρησιμοποιούνται για να υποδείξουν την παρουσία χημικών δεσμών. Οι απλοί δεσμοί αναπαρίστανται με απλές γραμμές, ενώ φυσικά οι διπλοί δεσμοί αναπαρίστανται με διπλές γραμμές. Περιστασιακά σχεδιάζονται τελείες δίπλα στα άτομα για να υποδείξουν την παρουσία μη συνδεδεμένων ηλεκτρονίων και ένα ζεύγος κουκκίδων αντιπροσωπεύει περίσσεια ηλεκτρονίων.
Οι δομές συντονισμού είναι όλες οι πιθανές διαφορετικές δομές Lewis που μπορεί να έχει ένα μόριο. Ο υπολογισμός του τυπικού φορτίου για ένα μόριο σάς επιτρέπει να προσδιορίσετε ποια δομή συντονισμού είναι πιο πιθανό να είναι η σωστή δομή του μορίου και η δομή Lewis που θεωρείται η πιο σωστή θα είναι η δομή που έχει τυπικά φορτία κατανεμημένα ομοιόμορφα σε όλο το μόριο. Κατά τον προσδιορισμό ενός τυπικού φορτίου καθώς σχετίζεται με δομές συντονισμού, το άθροισμα κάθε ενός από τα τυπικά φορτία πρέπει να ισούται με το συνολικό φορτίο του μορίου.
Σύνοψη επίσημης χρέωσης:
Ένα τυπικό φορτίο μπορεί να οριστεί ως το ηλεκτρικό φορτίο ενός ατόμου μέσα σε ένα μόριο και να υπολογιστεί προσδιορίζοντας τον συνολικό αριθμό ηλεκτρονίων σθένους μείον το ήμισυ των συνολικών ηλεκτρονίων που βρίσκονται σε έναν κοινό δεσμό μείον τον αριθμό των ηλεκτρονίων που δεν βρίσκονται στο μόριο. Μπορείτε να χρησιμοποιήσετε μια επίσημη φόρτιση για να υπολογίσετε την κατανομή των ηλεκτρικών φορτίων σε ένα μόριο.
Στοιχεία για το νιτρικό NO3
Το νιτρικό είναι ένα άλας που αποτελείται από νιτρικό οξύ και διάφορες αλκοόλες, καθώς και εστέρες, μερικές φορές αναφέρονται ως νιτρικό οξύ. Τα νιτρικά ιόντα έχουν μοριακή μάζα 63 και αποτελούνται από ένα άτομο αζώτου συνδεδεμένο με τρία ακριβώς ίδια άτομα οξυγόνου. Λάβετε υπόψη ότι τα νιτρικά άλατα διαφέρουν από τα νιτρώδη, τα οποία είναι άλατα που παράγονται από νιτρώδες οξέα και όχι από νιτρικό οξύ. Οι οργανικές ενώσεις που περιέχουν τη νίτρο λειτουργική ομάδα αναφέρονται ως νιτροενώσεις. Τα νιτρικά ιόντα μπορεί να είναι αρκετά επικίνδυνα και τοξικά και επηρεάζουν τους ανθρώπους μέσω της διαδικασίας της νιτρικής τοξίκωσης - μια κατάσταση όπου τα άτομα σιδήρου που βρίσκονται στην αιμοσφαιρίνη του αίματος οξειδώνονται και δεν μπορούν να μεταφέρουν οξυγόνο.

Τα νιτρικά άλατα απαντώνται μάλλον σε μεγάλα κοιτάσματα, ειδικά εναποθέσεις νιτρίνης. Αυτές οι εναποθέσεις νιτρίνης λειτουργούν ως κύριες γραμματοσειρές νιτρικού νατρίου, γνωστό και ως Chile Saltpeter. Τα νιτρώδη παράγονται από βακτήρια και οι νιτρικές ενώσεις που παράγει αυτό το βακτήριο χρησιμοποιούνταν ιστορικά για την πυρίτιδα και παράγονταν με ζύμωση. Τα νιτρικά άλατα χρησιμοποιούνται επίσης στα λιπάσματα λόγω των βιοαποικοδομήσιμων ιδιοτήτων τους και της υψηλής διαλυτότητάς τους. Τα κύρια νιτρικά λιπάσματα περιλαμβάνουν άλατα ασβεστίου, κάλιο, αμμώνιο και νάτριο. Το νιτρικό οξύ παράγεται επίσης κατά τη διάρκεια κεραυνών, λόγω των αλληλεπιδράσεων μεταξύ υδρατμών και διοξειδίου του αζώτου.
Ποια είναι η επίσημη χρέωση του NO3;
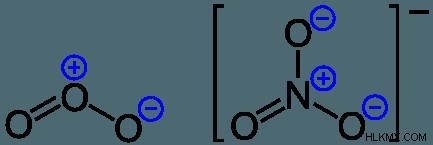
Η αναπαράσταση Lewis του ΝΟ3 είναι ευθυγραμμισμένη με έναν τρόπο όπου το άτομο αζώτου βρίσκεται στο κέντρο και περιφέρεται από τρία άτομα οξυγόνου. Το άζωτο έχει θετικό φορτίο επειδή έχει 4 ηλεκτρόνια σύνδεσης – 2 από τον διπλό δεσμό οξυγόνου και 1 από καθέναν από τους δεσμούς N – O. Ο εσωτερικός πυρήνας των ηλεκτρονίων σχετίζεται με μόλις 6 ηλεκτρόνια αντί για τα 7 που χρειάζονται για την ηλεκτρική ουδετερότητα, που σημαίνει ότι έχει θετικό φορτίο συνολικά.
Δεδομένου ότι το άτομο αζώτου έχει συνολικά μόνο 6 ηλεκτρόνια, έχει, επομένως, ένα τυπικό θετικό φορτίο. Τα οξυγόνα που έχουν διπλούς δεσμούς έχουν κοινά ή ιδιόκτητα οκτώ ηλεκτρόνια, επομένως θεωρούνται ουδέτερα. Τέλος, τα μεμονωμένα δεσμευμένα άτομα οξυγόνου έχουν εννέα ηλεκτρόνια συνδεδεμένα με αυτά και έχουν συνολικά αρνητικό φορτίο. Αυτό σημαίνει ότι το νιτρικό ιόν έχει συνολικό φορτίο -1.
Για να το θέσουμε διαφορετικά, κάθε άτομο οξυγόνου έχει 2 ηλεκτρόνια στο εσωτερικό του κέλυφος και 6 ηλεκτρόνια μέσα στο δεύτερο κέλυφος του ατόμου. Το οξυγόνο έχει χώρο για έως και οκτώ ηλεκτρόνια στο δεύτερο περίβλημά του. Τα τρία άτομα οξυγόνου «θέλουν» να έχουν 6 ηλεκτρόνια. Εν τω μεταξύ, το άζωτο έχει συνολικά 7 ηλεκτρόνια, πέντε στο δεύτερο κέλυφος και δύο ηλεκτρόνια στο εσωτερικό του φλοιό. Όπως το οξυγόνο, το άζωτο έχει χώρο για περισσότερα ηλεκτρόνια σε ένα δεύτερο κέλυφος, συγκεκριμένα, υπάρχει χώρος για άλλα τρία.
Δεδομένου ότι υπάρχουν πέντε ηλεκτρόνια στο εξωτερικό περίβλημα του αζώτου, το άζωτο μπορεί να ικανοποιηθεί δίνοντας αυτά τα πέντε ηλεκτρόνια μακριά και έχοντας μόνο τα δύο ηλεκτρόνια στο εσωτερικό του κέλυφος. Αυτό συμβαίνει συχνά όταν τα άτομα νατρίου αλληλεπιδρούν με άτομα χλωρίου. Το άτομο του νατρίου δίνει ένα μόνο ηλεκτρόνιο από το εξωτερικό του περίβλημα στο χλώριο, το οποίο σχηματίζει επιτραπέζιο αλάτι.
Αυτό σημαίνει ότι το άζωτο θα δωρίσει τα πέντε ηλεκτρόνια του εξωτερικού κελύφους του στα τρία άτομα οξυγόνου που το περιβάλλουν επειδή τα άτομα οξυγόνου έχουν μεγαλύτερη έλξη στα εξωτερικά ηλεκτρόνια του αζώτου από ότι ο πυρήνας του αζώτου. Αυτό σημαίνει ότι το άτομο αζώτου θα ρίξει πέντε ηλεκτρόνια, αλλά τα τρία άτομα οξυγόνου θέλουν έξι ηλεκτρόνια συνολικά. Έτσι θα υπάρχει ακόμα η επιθυμία για ένα τελευταίο ηλεκτρόνιο. Σε περιπτώσεις όπου τα νιτρικά άλατα συνδυάζονται με άλλα μόρια, όπως όταν το νάτριο συνδυάζεται με νιτρικό άλας για να σχηματίσει νιτρικό νάτριο ή NaNo3, το μεμονωμένο ηλεκτρόνιο που βρίσκεται στο εξωτερικό περίβλημα του νατρίου θα μεταφερθεί στο N03, το οποίο το καθιστά νιτρικό ιόν και καταλήγει να έχει μια χρέωση -1.




