NH3 (αμμωνία) Μοριακή μάζα και χημικές ιδιότητες

Αμμωνία είναι μια χημική ένωση που έχει τον τύπο NH3, που αποτελείται από ένα άτομο αζώτου και τρία άτομα υδρογόνου. Ημοριακή μάζα της NH3 (αμμωνία) είναι 17,031 g ανά mole. Οι χημικές ιδιότητες της αμμωνίας περιλαμβάνουν αμμωνία που έχει υψηλή σταθερότητα, είναι εύφλεκτη στον αέρα και σχηματίζει μονοξείδιο του αζώτου όταν συνδυάζεται με καταλύτη πλατίνας-ρόδιου στους περίπου 800°C.
Τι είναι ο τυφλοπόντικας;
Η μοριακή μάζα μιας χημικής ουσίας είναι η μάζα που κατέχεται από ένα μόνο γραμμομόριο αυτής της ουσίας. Για να καταλάβουμε γιατί η μοριακή μάζα μιας ουσίας είναι σημαντική, θα χρειαστεί πρώτα να ορίσουμε ένα mole. Ένα mole είναι μια μονάδα μέτρησης για χημικές ουσίες και επιτρέπει σε χημικούς ή άλλους επιστήμονες να προσδιορίσουν πόσες στοιχειώδεις οντότητες (μόρια ή άτομα) βρίσκονται σε μια ορισμένη ποσότητα μιας χημικής ουσίας. Ο αριθμός των στοιχειωδών οντοτήτων σε ένα mole είναι ισοδύναμος με τον αριθμό των ατόμων σε 12 g άνθρακα 12. Αυτός ο αριθμός αναφέρεται ως ο αριθμός του Avogadro, ο οποίος είναι 6,022×10^23. Αυτό σημαίνει ότι υπάρχουν 6,022×10 έως τις 23 στοιχειώδεις οντότητες που βρίσκονται σε ένα mole.
Γιατί λοιπόν ο τυφλοπόντικας είναι σημαντικός στη χημεία; Είναι σημαντικό να έχουμε μια μονάδα μέτρησης που αντιπροσωπεύει έναν μεγάλο αριθμό στοιχειωδών οντοτήτων, γιατί όταν συμβαίνουν χημικές αλλαγές περιλαμβάνουν την αναδιάταξη δισεκατομμυρίων ατόμων. Αυτά τα δισεκατομμύρια άτομα δεν μπορούν ρεαλιστικά να οραματιστούν ή να αναπαρασταθούν έγκαιρα, ωστόσο οι επιστήμονες πρέπει να έχουν μια μέθοδο αναπαράστασης ολόκληρης της ποσότητας των ατόμων. Για αυτόν τον λόγο, τα mole χρησιμοποιούνται για τη σύγκριση των βαρών των ουσιών με τον αριθμό των ατόμων και το βάρος μπορεί να ποσοτικοποιηθεί εμπειρικά μάλλον απλά σε σύγκριση με τον αριθμό των ατόμων.
Όταν κάνετε υπολογισμούς που περιλαμβάνουν δύο διαφορετικές χημικές ουσίες, είναι απαραίτητο να χρησιμοποιήσετε τον αριθμό και τις κρεατοελιές του Avogadro. Η χρήση του αριθμού του Avogadro είναι κρίσιμη για την κατανόηση τόσο του τρόπου συνδυασμού των μορίων όσο και της φύσης των αλληλεπιδράσεών τους. Ας εξετάσουμε πώς δύο άτομα υδρογόνου δημιουργούν ένα μόριο νερού όταν συνδυάζονται με ένα άτομο οξυγόνου. Θυμηθείτε ότι ένα mole H2O αποτελείται από δύο mole υδρογόνου και ένα mole οξυγόνου, επομένως αυτό μπορεί να αναπαρασταθεί ως 1 mole H2O =2 × 6,022×1023 υδρογόνου + 6,022×1023 Oxygen.
Μια αξιοσημείωτη ιδιότητα του αριθμού του Avogadro είναι ότι το μοριακό βάρος της ουσίας θα είναι ίσο με τη μοριακή μάζα της δεδομένης ουσίας. Για παράδειγμα, ένα mole νερού θα ζυγίζει 18,015 g, ενώ ένα μόριο νερού θα είναι 18,015 μονάδες ατομικής μάζας (AMU).
Σύνοψη:
Το μοριακό βάρος μιας ουσίας είναι ίσο με τη μάζα που έχει ένα γραμμομόριο μιας ουσίας. Για παράδειγμα, ένα mole νερού ζυγίζει περίπου 18,015 g και 18,015 μονάδες ατομικής μάζας είναι το μέσο μοριακό βάρος του νερού.
Τι είναι η μοριακή μάζα και γιατί είναι σημαντική;

Η γνώση της μοριακής μάζας μιας ουσίας είναι σημαντική επειδή η γραμμομοριακή μάζα γεφυρώνει τον αριθμό των γραμμομορίων σε ένα δείγμα της ουσίας και τη μάζα του υλικού, επομένως χωρίς τη μοριακή μάζα, δεν θα ήταν δυνατό να μετρηθεί άμεσα ο αριθμός των γραμμομορίων.
Κάθε άτομο ή ιόν έχει τη δική του μάζα, και όχι μόνο αυτό, αλλά υπάρχει και μια καθορισμένη μάζα για κάθε mole μιας ουσίας. Όταν έχετε ένα καθαρό στοιχείο, η μάζα που διαθέτει ένα mole από τα άτομα αυτού του στοιχείου σε γραμμάρια είναι ισοδύναμη με την ατομική μάζα αυτού του στοιχείου. Αυτό ισχύει είτε ο υπολογισμός γίνεται είτε σε γραμμάρια ανά mole είτε σε μονάδες ατομικής μάζας.
Η μοριακή μάζα μιας ουσίας είναι ίση με τη μάζα της ουσίας διαιρούμενη με την ποσότητα αυτής της ουσίας. Τα γραμμάρια ανά mole είναι το πώς μετράται η μοριακή μάζα. Για παράδειγμα, η μοριακή μάζα του τιτανίου είναι 47,88 g ανά mole ή 47,8 AMU. Αυτό σημαίνει ότι υπάρχουν 6,022×10 έως το 23ο άτομα τιτανίου σε 47,88 g τιτανίου.
Η ατομική μάζα σε γραμμάρια ανά mole είναι επίσης ισοδύναμη με τη χαρακτηριστική μοριακή μάζα αυτού του στοιχείου. Η μοριακή μάζα μιας ουσίας μπορεί να προσδιοριστεί μέσω εναλλακτικών μεθόδων, όπως ο πολλαπλασιασμός της σταθεράς μοριακής μάζας που είναι 1 g ανά mole με την ατομική μάζα στο AMU. Θα καταλήξετε να αθροίσετε την ατομική μάζα των διαφόρων συστατικών ατόμων για να προσδιορίσετε τη μοριακή μάζα μιας ένωσης που έχει πολλαπλά είδη ατόμων. Για να προσδιορίσετε τη μοριακή μάζα του NaCl, για παράδειγμα, πρέπει να βρείτε τόσο την ατομική μάζα του χλωρίου όσο και την ατομική μάζα του νατρίου. Η ατομική μάζα του νατρίου είναι 22,99 g ανά mole ενώ η ατομική μάζα του χλωρίου είναι 35,45 g ανά mole. Απλώς συνδυάζετε τις δύο μάζες για να λάβετε 58,44 g ανά mole, τη μοριακή μάζα NaCl.
Δομή της αμμωνίας
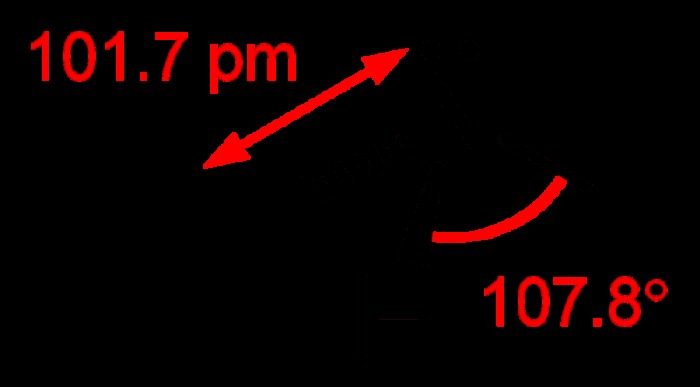
Η εξέταση της δομής της αμμωνίας αποκαλύπτει ότι είναι ένα ομοιοπολικό μόριο. Η επικάλυψη τριών υβριδικών τροχιακών SP3, καθώς και των τριών τροχιακών υδρογόνου, σχηματίζει αμμωνία. Υπάρχει ένα άλλο υβριδικό τροχιακό SP3 στο μόριο, αλλά αυτό το τελευταίο τροχιακό έχει μόνο ένα μοναχικό ζεύγος. Αυτή η δομή σημαίνει ότι το μόριο αμμωνίας έχει τριγωνικό μεσαίο σχήμα σε αυτό. Η γωνία του δεσμού υδρογόνου-αζώτου-υδρογόνου είναι 107,3°. Η γωνία δεσμού του δεσμού Η και Η είναι λίγο μικρότερη από την τετραεδρική γωνία των 109°. Η γωνία των δεσμών Η και Η είναι αποτέλεσμα του γεγονότος ότι ο δεσμός μοναχικού ζεύγους συχνά σπρώχνει τον δεσμό ΝΗ λίγο προς τα μέσα. Τόσο σε στερεά όσο και σε υγρή κατάσταση, οι δεσμοί υδρογόνου είναι υπεύθυνοι για τη σύνδεση της αμμωνίας.
Φυσικές ιδιότητες της αμμωνίας
Η αμμωνία είναι άχρωμη, ωστόσο, σε αντίθεση με κάποια άλλα άχρωμα αέρια, δεν είναι άοσμη. Στην πραγματικότητα, η αμμωνία έχει μια πολύ έντονη μυρωδιά και όταν εισπνέεται μπορεί να προκαλέσει βήχα, πνιγμό και δακρύρροια των ματιών. Λέγεται επίσης ότι έχει σαπουνάδα/αλκαλική γεύση. Η αμμωνία είναι ελαφρύτερη από τον αέρα, και έτσι ο κανονικός αέρας θα την εκτοπίσει καθώς κινείται προς τα κάτω και η αμμωνία θα συγκεντρωθεί σε υψηλή περιοχή. Η αμμωνία είναι υδατοδιαλυτή και το νερό μπορεί να διαλύσει σε αυτήν περίπου 1300 όγκους αερίου αμμωνίας. Χάρη στην υψηλή υδατοδιαλυτότητα της αμμωνίας, δεν μπορεί να συγκεντρωθεί σε ένα σώμα νερού. Η αμμωνία υγροποιείται σε θερμοκρασία δωματίου αρκετά εύκολα όταν εφαρμόζεται περίπου 10 ατμοσφαιρική πίεση. Η υγρή αμμωνία θα παγώσει περίπου στους 195,3 K (-77,8°C) και παράγει μια στερεά κρυσταλλική, λευκή δομή. Σε μία ατμοσφαιρική πίεση, η υγρή αμμωνία βράζει στους 239,6 K (- 33,5°C). Η αμμωνία χρησιμοποιείται συχνά ως ψυκτικό μέσο χάρη στην υψηλή λανθάνουσα θερμότητα εξάτμισης.
Χημικές ιδιότητες της αμμωνίας
Μία από τις κύριες χημικές ιδιότητες της αμμωνίας είναι η θερμική σταθερότητα. Η αμμωνία είναι μια πολύ σταθερή χημική ένωση, αλλά μπορεί να αποσυντεθεί σε άζωτο και υδρογόνο χρησιμοποιώντας έναν θερμαινόμενο μεταλλικό καταλύτη ή περνώντας μια ηλεκτρική εκκένωση μέσω της ένωσης. Μια άλλη χημική ιδιότητα της αμμωνίας είναι το γεγονός ότι είναι εύφλεκτη στον αέρα και σε περιβάλλον οξυγόνου, θα καεί. Το μονοξείδιο του αζώτου παράγεται όταν ο αέρας και η αμμωνία διέρχονται μέσω ενός καταλύτη ροδίου-πλατίνας στους περίπου 800°C.
Η αμμωνία είναι αναμίξιμη όταν συνδυάζεται με νερό. Όταν το νερό βράσει, η αμμωνία μπορεί να αφαιρεθεί από αυτό. Η αμμωνία καίγεται εύκολα μόνο σε μείγματα περίπου 15 έως 25% αέρα, επομένως πρέπει να υπάρχει σε πολύ στενά μείγματα αέρα. Ωστόσο, όταν καίγεται, βγάζει μια κιτρινοπράσινη φλόγα. Η καύση της αμμωνίας παράγει υδρογόνο και νερό μέσω της εξώθερμης αντίδρασης.
Τα μόρια αμμωνίας έχουν ενδιαφέρουσα σχέση με άλλα μόρια. Τα μόρια αμμωνίας πολύ συχνά δωρίζουν τα μόνα τους ζεύγη ηλεκτρονίων σε άλλα μόρια. Αυτή η ιδιότητα σημαίνει ότι ενεργούν παρόμοια με μια βάση Lewis. Τα μόρια της ΝΗ3 ιονίζονται σύμφωνα με την αντίδραση δωρεάς όταν τοποθετείται σε υδατικό διάλυμα. Η αντίδραση που κάνει την αμμωνία να δώσει το μοναδικό της ζεύγος ηλεκτρονίων έχει σταθερή ισορροπία 1,8 x 10^-5 στους 298K.
Χρήσεις για αμμωνία
Μία από τις κύριες χρήσεις της αμμωνίας είναι ως συστατικό σε λιπάσματα. Όταν η αμμωνία χρησιμοποιείται για τη δημιουργία λιπασμάτων και αυτό το λίπασμα χρησιμοποιείται στο έδαφος, η απόδοση καλλιεργειών όπως το σιτάρι αυξάνεται. Η αμμωνία χρησιμοποιείται επίσης στη δημιουργία πολλών ενώσεων που περιέχουν άζωτο. Σχεδόν όλες οι συνθετικές ενώσεις που περιέχουν άζωτο δημιουργούνται χρησιμοποιώντας αμμωνία ως καταλύτη/συστατικό. Η αμμωνία χρησιμοποιείται επίσης για τη δημιουργία αμινοξέων, φαινολουδραζίνης και υδροκυανίου.
Η αμμωνία είναι επίσης ένα κύριο συστατικό σε πολλά οικιακά καθαριστικά. Το υδροξείδιο του αμμωνίου είναι NH3 διαλυμένο στο νερό και καθαρίζει τις επιφάνειες χωρίς να αφήνει πίσω του πολλές ραβδώσεις. Τα καθαριστικά με βάση την αμμωνία είναι αποτελεσματικά στον καθαρισμό επιφανειών που καλύπτονται με βρωμιά. Τα καθαριστικά με αμμωνία κυμαίνονται κάπου από 5 έως 10% κατά βάρος αμμωνίας. Διαλύματα που αποτελούνται από περίπου 16 έως 25% αμμωνία παρέχονται συχνά στους μικροοργανισμούς ως πηγή αζώτου όταν χρησιμοποιούνται από τη βιομηχανία ζύμωσης. Τα διαλύματα αμμωνίας χρησιμοποιούνται επίσης συχνά ως αντιμικροβιακός παράγοντας για τη μείωση της μόλυνσης του βοείου κρέατος.




