Ποια είναι η χρέωση του CO3;

Η ουσία με τον χημικό τύπο CO3 ονομάζεται ανθρακικό . Το ανθρακικό αποτελείται από 1 άτομο άνθρακα και 3 άτομα οξυγόνου και έχει ηλεκτρικό φορτίο −2 . Αυτό το αρνητικό φορτίο σημαίνει ότι ένα μόνο ιόν ανθρακικού έχει 2 περισσότερα ηλεκτρόνια από τα πρωτόνια.
Το ανθρακικό είναι ένα εύκαμπτο πολυατομικό ιόν και χαρακτηρίζεται από την τάση του να σχηματίζει ενώσεις αλάτων με μέταλλα αλκαλίων και αλκαλικών γαιών. Οι ανθρακικές ενώσεις είναι το κύριο συστατικό πολλών τύπων ιζηματογενών πετρωμάτων, με πιο γνωστό τον ασβεστόλιθο που αποτελείται κυρίως από ανθρακικό ασβέστιο (CaCO3 ). Οι ανθρακικές ενώσεις αποτελούν επίσης τα κελύφη των μαλακίων και των κοραλλιών, καθώς και σε καθαριστικά όπως το ανθρακικό νάτριο (Na2 CO3 ) και ανθρακικό κάλιο (K2 CO3 ). Οι ανθρακικές ενώσεις βρίσκονται επίσης στο ανθρώπινο σώμα, όπου χρησιμοποιούνται ως ρυθμιστικό διάλυμα για τη ρύθμιση των επιπέδων pH στο αίμα.
Το ανθρακικό είναι ένα πολυατομικό ιόν, δεδομένου ότι είναι ένα ιόν που αποτελείται από 2 ή περισσότερα άτομα. Αρχικά, ας δούμε τη γενική έννοια ενός ιόντος και ας επεξεργαστούμε την πιο περίπλοκη ιδέα ενός πολυατομικού ιόντος.
Τι είναι ένα ιόν;
Με λίγα λόγια, ένα ιόν είναι ένα άτομο που έχει άνισες ποσότητες πρωτονίων και ηλεκτρονίων. Όλα τα άτομα αποτελούνται από τρία είδη σωματιδίων, πρωτόνια, νετρόνια και ηλεκτρόνια. Τα πρωτόνια και τα νετρόνια υπάρχουν μαζεμένα στον πυρήνα του ατόμου ενώ τα ηλεκτρόνια υπάρχουν σε τροχιακά κελύφη που περιβάλλουν τον πυρήνα. κάθε σωματίδιο έχει ένα σχετικό ηλεκτρικό φορτίο. Τα πρωτόνια έχουν φορτίο +1 και τα ηλεκτρόνια έχουν φορτίο −1. Τα νετρόνια έχουν ουδέτερο ηλεκτρικό φορτίο 0.
Σε ένα κανονικό άτομο, υπάρχουν ίσες ποσότητες πρωτονίων και ηλεκτρονίων. Σε τέτοια άτομα, τα θετικά φορτία των πρωτονίων και τα αρνητικά φορτία των ηλεκτρονίων είναι ακριβώς ίσα και αντίθετα, επομένως τα φορτία ακυρώνονται και το άτομο είναι συνολικά ηλεκτρικά ουδέτερο. Αυτό δεν συμβαίνει πάντα όμως. Τα άτομα μπορούν να αποκτήσουν ή να χάσουν ηλεκτρόνια και έτσι να λάβουν ένα συνολικό αρνητικό ή θετικό φορτίο. Τα άτομα με μη μηδενικά ηλεκτρικά φορτία ονομάζονται ιόντα.
Υπάρχουν δύο κύρια είδη ιόντων. Τα θετικά φορτισμένα άτομα ονομάζονται κατιόντα . Τα κατιόντα σχηματίζονται όταν ένα άτομο χάνει ηλεκτρόνια. Τώρα υπάρχουν περισσότερα πρωτόνια από ηλεκτρόνια, επομένως το άτομο έχει ένα συνολικό θετικό φορτίο. Τα αρνητικά φορτισμένα ιόντα ονομάζονται ανιόντα και σχηματίζονται όταν ένα άτομο αποκτά ηλεκτρόνια. Τώρα υπάρχουν περισσότερα ηλεκτρόνια από πρωτόνια, επομένως το άτομο έχει ένα συνολικό αρνητικό φορτίο.
Πάρτε για παράδειγμα το νάτριο (Na). Ένα άτομο νατρίου έχει 11 πρωτόνια και 11 ηλεκτρόνια. Το νάτριο έχει σχετικά χαμηλή ενέργεια ιονισμού, που σημαίνει ότι τα ηλεκτρόνια του μπορούν να αφαιρεθούν εύκολα. Ως εκ τούτου, το νάτριο έχει την τάση να χάνει ηλεκτρόνια και σχηματίζουν θετικό κατιόν. Το ηλεκτρικό φορτίο ενός ιόντος γράφεται συνήθως ως εκθέτης δίπλα στο χημικό σύμβολο. Στην περίπτωση του νατρίου, το νάτριο συνήθως χάνει 1 ηλεκτρόνιο και έτσι σχηματίζει ένα ιόν με φορτίο +1, γραμμένο Na. Το φθόριο (F), από την άλλη πλευρά, έχει υψηλή ηλεκτραρνητικότητα και συλλαμβάνει εύκολα επιπλέον ηλεκτρόνια. Ένα άτομο φθορίου θα πάρει ένα επιπλέον ηλεκτρόνιο για να γεμίσει το εξωτερικό του περίβλημα και θα δημιουργήσει ένα ιόν με φορτίο −1, γραμμένο F
Τα ιόντα σχηματίζουν δεσμούς μέσω της ισχυρής ηλεκτροστατικής έλξης μεταξύ θετικών και αρνητικών ιόντων. Στην περίπτωση του χλωριούχου νατρίου (NaCl), ένα κατιόν νατρίου θα συνδεθεί με ένα ανιόν χλωρίου όπως αυτό:
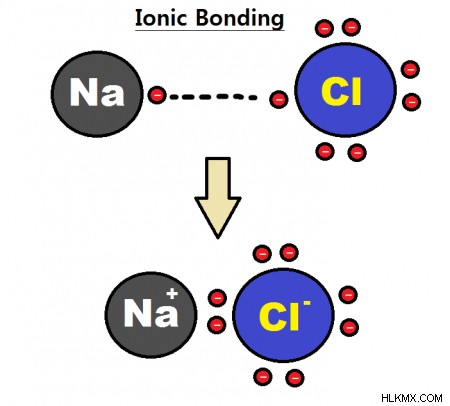
Οι ιοντικοί δεσμοί τείνουν να είναι ισχυρότεροι από τους ομοιοπολικούς δεσμούς λόγω της ισχυρότερης ηλεκτροστατικής αλληλεπίδρασης μεταξύ ιόντων. Οι ιοντικές ενώσεις είναι συνήθως εύθραυστες, έχουν υψηλά σημεία τήξης/βρασμού και διαλύονται εύκολα σε πολικούς διαλύτες.
Πολυατομικά ιόντα
Τα πολυατομικά ιόντα, όπως θα υπονοούσε το όνομα, είναι ιόντα που αποτελούνται από πολλαπλά άτομα. Με άλλα λόγια, ένα πολυατομικό ιόν είναι απλώς ένα μόριο που έχει άνιση ποσότητα πρωτονίων και ηλεκτρονίων. Όπως τα μονοατομικά ιόντα, τα πολυατομικά ιόντα έχουν συνολικό θετικό ή αρνητικό φορτίο.
Πάρτε αμμώνιο (NH4 ) για παράδειγμα. Το αμμώνιο είναι ένα πολυατομικό ιόν που αποτελείται από ένα μόνο άτομο αζώτου και 4 άτομα υδρογόνου. Το αμμώνιο έχει συνολικά 9 πρωτόνια (5 για το άζωτο και 1 για κάθε υδρογόνο) αλλά μόνο 8 ηλεκτρόνια. Έτσι, το αμμώνιο έχει συνολικό φορτίο +1. Το αμμώνιο μπορεί να σχηματιστεί από την πρωτονίωση (προσθήκη πρωτονίου) στην αμμωνία (NH3 ). Η προσθήκη ενός επιπλέον πρωτονίου δίνει σε ολόκληρο το μόριο ένα καθαρό θετικό φορτίο.
Τα πολυατομικά ιόντα παρατηρούνται πιο συχνά στο πλαίσιο χημικών αντιδράσεων οξέος-βάσης. Τα όξινα διαλύματα σχηματίζονται με διάσταση ατόμων υδρογόνου από μια ουσία. Αυτή η διαδικασία έχει ως αποτέλεσμα ελεύθερα πρωτόνια (ιόντα Η) και το αντίστοιχο πολυατομικό συζυγές ζεύγος βάσεων. Για παράδειγμα, θειικό οξύ (H2 SO4 ) θα διασπαστεί σε έναν διαλύτη για να δημιουργήσει 2 ιόντα Η και τη συζευγμένη βάση του, ένα θειικό πολυατομικό ιόν SO4 .
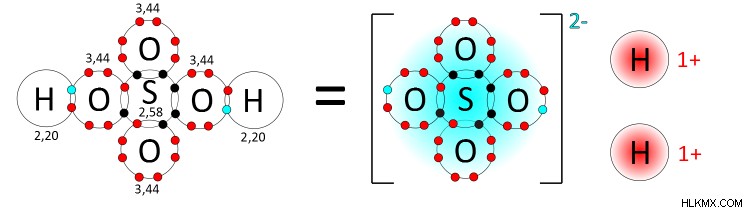
Παρατηρήστε πώς το θειικό ιόν διατηρεί τα δύο ηλεκτρόνια που μοιράζονταν αρχικά τα άτομα υδρογόνου. Η προσθήκη των δύο ηλεκτρονίων από τα άτομα υδρογόνου που έχουν διαχωριστεί δίνει στο θειικό ιόν το συνολικό αρνητικό του φορτίο −2.
Ιόντα έναντι πολικότητας
Τα ιόντα και τα πολικά μόρια δεν είναι τα ίδια πράγματα. Τα πολικά μόρια είναι μόρια που έχουν ηλεκτρικό δίπολο λόγω της άνισης χωρικής κατανομής των ατόμων. Τα ιόντα είναι άτομα που έχουν άνισες ποσότητες ηλεκτρονίων και πρωτονίων. Οι πολικές ενώσεις περιέχουν ομοιοπολικούς δεσμούς, οι ιοντικές ενώσεις όχι. Επιπλέον, τα πολικά μόρια έχουν μερικά ηλεκτρικά φορτία, ενώ τα μονοατομικά και πολυατομικά ιόντα έχουν ακέραια ηλεκτρικά φορτία.
Ανθρακικό ως πολυατομικό ιόν
Το ανθρακικό είναι το απλούστερο είδος ιόντων οξοάνθρακα. αποτελείται από 3 άτομα οξυγόνου συνδεδεμένα με ένα κεντρικό άτομο άνθρακα και έχει συμμετρική τριγωνική επίπεδη γεωμετρία. Το ανθρακικό έχει μοριακή μάζα περίπου 60 g/mol. Είναι η συζυγής βάση του ανθρακικού οξέος (H2 CO3 ) και μπορεί να γίνει μέσω της διάστασης του ανθρακικού οξέος σε έναν διαλύτη.
Η ατομική δομή ενός ανθρακικού ιόντος δεν μπορεί να αναπαρασταθεί με μία μόνο δομή Lewis. Η κοινή λογική θα έδειχνε ότι ένα ανθρακικό άτομο αποτελείται από ένα κεντρικό άτομο άνθρακα που μοιράζεται δύο απλούς δεσμούς με αρνητικά οξυγόνα και έναν διπλό δεσμό με ένα ουδέτερο οξυγόνο. Η εμπειρική παρατήρηση δείχνει ότι το ιόν είναι εντελώς συμμετρικό και κάθε δεσμός και άτομο οξυγόνου είναι ισοδύναμα. Έτσι, το ανθρακικό αντιπροσωπεύεται κανονικά από μια δομή συντονισμού Lewis:

Η πραγματική δομή ηλεκτρονίων ενός ανθρακικού ιόντος θεωρείται ότι είναι ένας μέσος όρος αυτών των τριών χωριστών ψηφίων.
Τα ανθρακικά ιόντα είναι ηλεκτρικά αρνητικά και έτσι έχουν ισχυρή τάση να σχηματίζουν ιοντικούς δεσμούς με θετικά φορτισμένα κατιόντα. Η προκύπτουσα ουσία αναφέρεται γενικά ως ανθρακικό άλας. Γενικά, τα ανθρακικά ιόντα σχηματίζουν άλατα με μέταλλα αλκαλίων και αλκαλικών γαιών της ομάδας 1 και 2. Τα μέταλλα των αλκαλίων και των αλκαλικών γαιών, όπως το νάτριο, το κάλιο, το ασβέστιο και το μαγνήσιο, τείνουν να σχηματίζουν θετικά κατιόντα έτσι ώστε να συνδέονται εύκολα με αρνητικά ανθρακικά ανιόντα. Ένα από τα πιο κοινά ανθρακικά άλατα είναι το ανθρακικό ασβέστιο (CaCO3 ). Το ανθρακικό ασβέστιο είναι ένα άλας που σχηματίζεται από έναν ιοντικό δεσμό μεταξύ ενός κατιόντος ασβεστίου (Ca) και ενός ανθρακικού ανιόντος. Άλλα κοινά ανθρακικά άλατα περιλαμβάνουν το ανθρακικό κάλιο (K2 CO3 ), ανθρακικό μαγνήσιο (MgCO3 ) και ανθρακικό νάτριο (Na2 CO3 ).
Εμφανίσεις ανθρακικού
Το ανθρακικό ασβέστιο είναι ένα κύριο συστατικό των περισσότερων ειδών ιζηματογενών πετρωμάτων. Ο ασβεστόλιθος, για παράδειγμα, αποτελείται κυρίως από ανθρακικό ασβέστιο. Ο ασβεστόλιθος μπορεί να διαλυθεί με νερό λόγω της ιοντικής του σύστασης. Η διάλυση του ασβεστόλιθου στο νερό δίνει κατιόντα ασβεστίου και ανθρακικά ανιόντα. Η εναπόθεση ανθρακικών αλάτων από μεταλλικό νερό είναι ο κύριος μηχανισμός πίσω από το σχηματισμό σταλακτιτών και σταλαγμιτών στα σπήλαια.

Το ανθρακικό είναι επίσης μια σημαντική βιολογική ουσία. Προφανώς, οι ανθρακικές ενώσεις απεκκρίνονται από το ανθρώπινο σώμα για τη ρύθμιση των εσωτερικών επιπέδων pH. Για παράδειγμα, όταν το pH του αίματος είναι πολύ χαμηλό, που σημαίνει ότι το αίμα είναι όξινο και έχει υψηλή συγκέντρωση ιόντων υδρογόνου, το σώμα παράγει ανθρακικά ιόντα. Τα ανθρακικά ιόντα απορροφούν τα πλεονάζοντα πρωτόνια που ανεβάζουν το pH του αίματος πίσω στα φυσιολογικά επίπεδα. Όταν το pH του αίματος είναι πολύ υψηλό, τα νεφρά εκκρίνουν διττανθρακικά ιόντα (HCO3 ), τα οποία διασπούν και εισάγουν περισσότερα ιόντα υδρογόνου στο αίμα. Ο ίδιος μηχανισμός βρίσκεται πίσω από τη χρήση ανθρακικών ενώσεων στα αντιόξινα. Τα ανθρακικά ιόντα αντιδρούν και εξουδετερώνουν το γαστρικό οξύ, το οποίο ανακουφίζει τα συμπτώματα της παλινδρόμησης οξέος και της δυσπεψίας.
Οι ανθρακικές ενώσεις παίζουν επίσης σημαντικό ρόλο στο σχηματισμό του διοξειδίου του άνθρακα στην ατμόσφαιρα. Πολλοί θαλάσσιοι οργανισμοί χρησιμοποιούν συστήματα ανθρακικού ρυθμιστικού διαλύματος για να ρυθμίσουν τα εσωτερικά τους επίπεδα pH. Εκπέμπουν αυτές τις ανθρακικές ενώσεις οι οποίες με τη σειρά τους μετατρέπονται σε διοξείδιο του άνθρακα και απελευθερώνονται στην ατμόσφαιρα από τους ωκεανούς της Γης. Τα ανθρακικά συστήματα στους ωκεανούς είναι ένας από τους κύριους φυσικούς παραγωγούς ατμοσφαιρικού διοξειδίου του άνθρακα. Η αύξηση της θερμοκρασίας των ωκεανών μπορεί να οδηγήσει στον σχηματισμό περισσότερου διοξειδίου του άνθρακα από ανθρακικές ενώσεις που είναι διαλυμένες στον ωκεανό, οδηγώντας σε υψηλότερες συγκεντρώσεις διοξειδίου του άνθρακα στην ατμόσφαιρα.
Στο πλαίσιο της οργανικής χημείας, οι λειτουργικές ομάδες που αποτελούνται από έναν μόνο άνθρακα και 3 οξυγόνα ονομάζονται συχνά ανθρακικά. Αν και τεχνικά δεν είναι πολυατομικά ιόντα, οι ανθρακικές λειτουργικές ομάδες διατηρούν πολλές από τις ιδιότητες των ελεύθερα υπαρχόντων ιοντικών εξαδέλφων τους, συμπεριλαμβανομένων των ιδιοτήτων τους ως διαλύτη.




