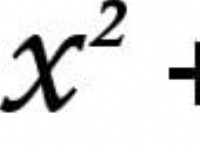Πώς μέτρησε η ηλεκτροαρνητικότητα του Pauling;
προσέγγιση του Pauling:
1. Ενέργειες δεσμών: Ο Pauling αναγνώρισε ότι η δύναμη ενός δεσμού μεταξύ δύο ατόμων εξαρτάται από τη διαφορά ηλεκτροαρνησίας τους. Μια μεγαλύτερη διαφορά ηλεκτροαρνητικότητας οδηγεί σε έναν πιο πολικό δεσμό (ένα άτομο προσελκύει τα κοινόχρηστα ηλεκτρόνια πιο έντονα), με αποτέλεσμα έναν ισχυρότερο δεσμό.
2. Συγκρίνοντας τις ενέργειες των δεσμών: Συγκρίθηκε η πειραματική ενέργεια δεσμού ενός ετερονομικού ομολόγου (π.χ. Η-CL) με τον μέσο όρο των ομοπυρηνικών ομολόγων (π.χ. Η-Η και CL-CL).
3. Η διαφορά ηλεκτροαρνητικότητας: Η διαφορά μεταξύ των πειραματικών και των μέσων ενεργειών ομολόγων είναι ανάλογη με τη διαφορά ηλεκτροαρνητικότητας μεταξύ των δύο ατόμων. Αυτή η διαφορά αντιπροσωπεύεται από την ελληνική επιστολή "chi" (χ).
4. αυθαίρετη ανάθεση: Ο Pauling ανέθεσε το φθόριο, το πιο ηλεκτροαρνητικό στοιχείο, μια αυθαίρετη τιμή 4.0 στην κλίμακα του. Στη συνέχεια, υπολόγισε την ηλεκτροαρνητικότητα άλλων στοιχείων σε σχέση με το φθόριο χρησιμοποιώντας τη μέθοδο ενέργειας δεσμού.
Βασικά σημεία:
* Δεν είναι άμεση μέτρηση: Η μέθοδος του Pauling βασίζεται σε έμμεσες μετρήσεις των ενεργειών των δεσμών και τη σχέση τους με την ηλεκτροαρνητικότητα.
* Σχετική κλίμακα: Οι τιμές ηλεκτροαρνητικότητας στην κλίμακα του Pauling είναι σε σχέση μεταξύ τους, όχι απόλυτες μετρήσεις.
* Εμπειρική προσέγγιση: Η κλίμακα βασίζεται σε πειραματικά δεδομένα και βασίζεται σε παρατηρήσεις της χημικής συμπεριφοράς.
Περιορισμοί:
* Η κλίμακα του Pauling δεν αντιπροσωπεύει τη διαφορετική ηλεκτροαρνητικότητα ενός στοιχείου σε διαφορετικά χημικά περιβάλλοντα.
* Εφαρμόζεται κυρίως σε ομοιοπολικά ομόλογα.
Άλλες κλίμακες ηλεκτροαρνητικότητας:
Έχουν αναπτυχθεί αρκετές άλλες κλίμακες ηλεκτροαρνητικότητας, όπως η κλίμακα Mulliken και η κλίμακα Allred-Rochow. Αυτές οι κλίμακες χρησιμοποιούν διαφορετικές προσεγγίσεις, αλλά στοχεύουν στην ποσοτικοποίηση της ίδιας θεμελιώδους ιδιοκτησίας των ατόμων.