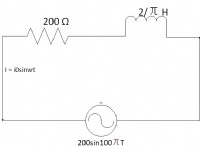
Ποια διαμοριακή δύναμη επηρεάζει το σημείο τήξης;
* LDFs είναι ο ασθενέστερος τύπος διαμοριακής δύναμης. Προκύπτουν από προσωρινές διακυμάνσεις στην κατανομή ηλεκτρονίων γύρω από τα μόρια, δημιουργώντας προσωρινά δίπολα που προκαλούν δίπολα σε γειτονικά μόρια.
* LDFs υπάρχουν σε όλες τις ουσίες, ακόμη και μη πολικές. Ωστόσο, η αντοχή τους αυξάνεται με το μέγεθος και την επιφάνεια του μορίου. Τα μεγαλύτερα μόρια έχουν περισσότερα ηλεκτρόνια και μεγαλύτερες πιθανότητες προσωρινού σχηματισμού διπόλων.
* Άλλες διαμοριακές δυνάμεις (διπολική-διπολική και υδρογόνο) είναι ισχυρότερες. Περιλαμβάνουν μόνιμα διπόλια ή ισχυρά αξιοθέατα μεταξύ υδρογόνου και ηλεκτροαρνητικών ατόμων όπως οξυγόνο, άζωτο ή φθόριο.
Επομένως, οι LDFs έχουν το μικρότερο αντίκτυπο στο σημείο τήξης σε σύγκριση με τις αλληλεπιδράσεις διπολικής-δίπολης και τη δέσμευση υδρογόνου.
Παράδειγμα:
* ήλιο (He) είναι ένα ευγενές αέριο με μόνο LDFs που κρατούν τα άτομα του μαζί. Το σημείο τήξης του είναι εξαιρετικά χαμηλό (-272.2 ° C).
* νερό (h₂o) Έχει δεσμό υδρογόνου, μια πολύ ισχυρότερη δύναμη από τα LDFs. Αυτό έχει ως αποτέλεσμα ένα σχετικά υψηλό σημείο τήξης των 0 ° C.