Από τι δημιουργούνται οι φυσαλίδες όταν βράζει το νερό;
Το νερό βράζει όταν η ενέργεια από τη θερμότητα είναι αρκετά μεγάλη ώστε να σπάσει τους δεσμούς υδρογόνου μεταξύ των μορίων του νερού. Το αέριο που απελευθερώνεται από το βραστό νερό αποτελείται από οξυγόνο και διοξείδιο του άνθρακα.
Αν έχετε βράσει ποτέ νερό, θα έχετε παρατηρήσει ότι καθώς το νερό ζεσταίνεται, σχηματίζονται πολύ μικροσκοπικές φυσαλίδες που ανεβαίνουν από κάτω προς τα πάνω. Αρχικά, οι φυσαλίδες είναι λίγες, αλλά καθώς το νερό γίνεται πιο ζεστό, αρχίζουν να σχηματίζονται περισσότερες φυσαλίδες μεγαλύτερου μεγέθους. Η περαιτέρω αύξηση της θερμότητας έχει ως αποτέλεσμα ακόμη μεγαλύτερες φυσαλίδες που σχηματίζονται αρκετά συχνά και ανεβαίνουν αμέσως στην κορυφή. Αυτή η κλιμάκωση φτάνει στο μέγιστο όταν το νερό αρχίζει να βράζει.
Αλλά γιατί το βραστό νερό κάνει φυσαλίδες;
Η απάντηση σε αυτό έχει να κάνει με τη χημεία του ίδιου του νερού. Πιο συγκεκριμένα, έχει να κάνει με όλες τις διαλυμένες ουσίες στο νερό, καθώς και με τη φύση των δεσμών μεταξύ των μορίων του νερού.
Χημικές ιδιότητες των μορίων νερού
Κάθε μόριο νερού αποτελείται από δύο άτομα υδρογόνου (Η) και ένα άτομο οξυγόνου (Ο). Και τα δύο άτομα Η είναι ομοιοπολικά συνδεδεμένα με το μοναδικό άτομο Ο. Κάθε στοιχείο στη φύση προσπαθεί να φτάσει σε μια κατάσταση της χαμηλότερης δυνατής ενέργειας. Αυτή η κατάσταση επιτυγχάνεται με την απώλεια ή την απόκτηση ηλεκτρονίων για την επίτευξη της πλησιέστερης διαμόρφωσης ευγενών αερίων.
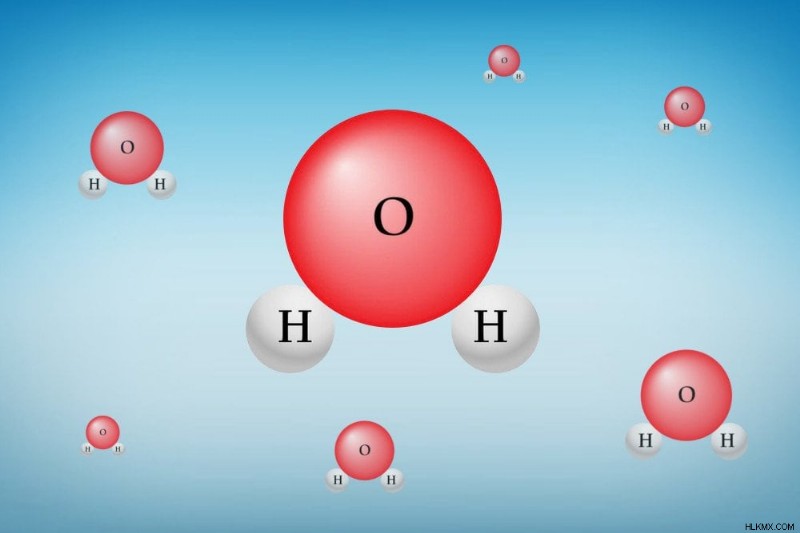
Απεικόνιση μορίου νερού
Ένα άτομο οξυγόνου έχει έξι ηλεκτρόνια στην (εξώτατη) στιβάδα του σθένους. Το πλησιέστερο ευγενές αέριο, το Νέον, έχει οκτώ ηλεκτρόνια στο κέλυφος σθένους. Έτσι, το O έχει μια ισχυρή τάση να αποκτά δύο ηλεκτρόνια και να επιτυγχάνει μια σταθερή ηλεκτρονική διαμόρφωση (εισέρχεται στη χαμηλότερη ενεργειακή κατάσταση). Ένα υδρογόνο έχει ένα ηλεκτρόνιο στο περίβλημα σθένους του, ενώ το πλησιέστερο ευγενές αέριο, το Ήλιο, έχει δύο ηλεκτρόνια στο κέλυφος σθένους του. Έτσι, το H τείνει να κερδίσει ένα ηλεκτρόνιο για να αποκτήσει μια σταθερή ηλεκτρονική διαμόρφωση.
Και τα δύο άτομα Η μοιράζονται ένα ηλεκτρόνιο το καθένα με το Ο, ενώ το Ο μοιράζεται δύο ηλεκτρόνια, ένα για κάθε Η. Αυτός είναι ένας ομοιοπολικός δεσμός. Το οξυγόνο έχει μια ισχυρή τάση να προσελκύει κοινά ηλεκτρόνια προς τον εαυτό του, λόγω μιας ιδιότητας που ονομάζεται ηλεκτραρνητικότητα. Έτσι, τα ηλεκτρόνια περνούν περισσότερο χρόνο κοντά στο άτομο Ο παρά στο άτομο Η, με αποτέλεσμα ένα μερικό αρνητικό φορτίο στο Ο και ένα μερικό θετικό φορτίο στο Η.
Η γεωμετρία ενός μορίου νερού είναι τέτοια που τα φορτία δεν ακυρώνονται και υπάρχει διαχωρισμός των κέντρων φορτίου (πόλωση). Όταν δύο μόρια νερού με ελαφρά πόλωση πλησιάζουν το ένα το άλλο, το μερικώς αρνητικό Ο ενός μορίου έλκει το μερικώς θετικό Η του άλλου μορίου για να σχηματίσει έναν ασθενή διαμοριακό δεσμό. Αυτό ονομάζεται Δεσμός Υδρογόνου και είναι η δύναμη που είναι υπεύθυνη για τη συγκράτηση των μορίων του νερού.

Οραματίστηκε ο δεσμός υδρογόνου.
Καθώς ο δεσμός υδρογόνου είναι αδύναμος, το νερό παραμένει υγρό σε θερμοκρασία δωματίου και καθώς η θερμοκρασία αυξάνεται, τα μόρια αποκτούν περισσότερη ενέργεια για να ξεπεράσουν τους διαμοριακούς δεσμούς υδρογόνου. Στους 100oC, η ενέργεια είναι αρκετή για να απελευθερωθούν τα μόρια.
Διαλυμένες ουσίες στο νερό
Η διάλυση μιας ουσίας σε μια άλλη είναι δυνατή μόνο όταν υπάρχει αλληλεπίδραση μεταξύ των μορίων των δύο ουσιών. Ομοίως, ορισμένα αέρια, π.χ., O2, CO2, N2, NH3 και SO2, διαλύονται στο νερό επειδή υπάρχει κάποια ελκυστική αλληλεπίδραση μεταξύ των μορίων του νερού και των μορίων του αερίου.
Υπάρχουν δύο τρόποι με τους οποίους τα αέρια μπορούν να διαλυθούν στο νερό:ο δεσμός van der Waals και ο δεσμός υδρογόνου.
Τα ετεροπυρηνικά μόρια (δηλαδή που έχουν άτομα από διαφορετικά στοιχεία), όπως το NH3 ή το CO2, έχουν διαφορά ηλεκτραρνητικότητας μεταξύ των ατόμων. Τα N και O είναι πιο ηλεκτραρνητικά από τα H και C, αντίστοιχα. Έτσι, το Ν και το Ο παραμένουν μερικώς αρνητικά και τα Η και Γ γίνονται μερικώς θετικά. Αυτό οδηγεί στη μερική πόλωση των μορίων NH3 και CO2.
Τα αρνητικά άκρα (Ν και Ο) έλκονται προς το μερικώς θετικό Η του νερού. Εν τω μεταξύ, τα θετικά άκρα (Η και Γ) έλκονται από το μερικώς αρνητικό Ο του νερού. Αυτός είναι δεσμός υδρογόνου. Όσο μεγαλύτερη είναι η πόλωση του αέριου μορίου, τόσο καλύτερα διαλύεται στο νερό.
Τα ομοπυρηνικά μόρια (δηλαδή που έχουν άτομα του ίδιου στοιχείου), όπως το Ο2 και το Ν2, είναι μη πολικά και είναι ελάχιστα διαλυτά (πολύ χαμηλή διαλυτότητα) στο νερό. Οι αδύναμες δυνάμεις έλξης van der Waals συγκρατούν αυτά τα αέρια με μόρια νερού. Αυτές είναι πολύ πιο αδύναμες από τις αλληλεπιδράσεις διπόλου-διπόλου.
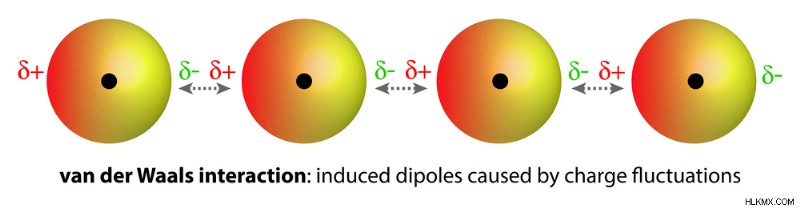
Ασθενείς δυνάμεις van der Waals προκύπτουν λόγω μιας αλλαγής της κατανομής των ηλεκτρονίων φορτίου γύρω από τα άτομα, με αποτέλεσμα μια προσωρινή επαγόμενη πόλωση. (Φωτογραφία:magnetix/Shutterstock)
Η διαλυτότητα των αερίων στο νερό μειώνεται όσο αυξάνεται η θερμοκρασία.
Η ακολουθία των γεγονότων όταν το νερό βράζει
Ας πάρουμε υγρό νερό σε θερμοκρασία δωματίου (25oC). Σε αυτή τη θερμοκρασία, η διαλυτότητα του O2 είναι 8,27 mg/L και του CO2 είναι 1,5 g/L. Καθώς η θερμοκρασία αυξάνεται, τα μόρια του αερίου και του νερού αποκτούν περισσότερη κινητική ενέργεια. Αυτή η ενέργεια διευκολύνει όλα τα μόρια να ξεπεράσουν τη διαμοριακή έλξη. Στους 50oC, η διαλυτότητα του Ο2 μειώνεται στα 2,75 mg/L και του CO2 στα 0,75 g/L. Αυτή η μείωση της διαλυτότητας σημαίνει ότι τα αέρια μόρια μπορούν να υπερνικήσουν τις ασθενείς διαμοριακές έλξεις. Δεδομένου ότι τα μόρια αερίου έχουν πυκνότητα μικρότερη από αυτή του νερού, ανεβαίνουν στην κορυφή ως φυσαλίδες . Ομοπυρηνικά μόρια όπως το N2 και το O2 εκπέμπονται σε χαμηλότερες θερμοκρασίες λόγω των ασθενών δυνάμεων van der Waals. Η περαιτέρω αύξηση της θερμοκρασίας έχει ως αποτέλεσμα τη δημιουργία φυσαλίδων από πολικά μόρια όπως το CO2 και το NH3, τα οποία συγκρατούνται από αλληλεπιδράσεις διπόλου-διπόλου.

Μόρια αερίου που βγαίνουν από το νερό. (Προστασία φωτογραφίας:Egoreichenkov Evgenii/Shutterstock)
Αυτή η φυσαλίδα συνεχίζεται μέχρι να επιτευχθεί το σημείο βρασμού του νερού. Η θέρμανση του νερού δεν είναι εντελώς ομοιόμορφη, που σημαίνει ότι υπάρχουν περιοχές με υψηλότερες και χαμηλότερες θερμοκρασίες. Σε θερμοκρασίες άνω των 90oC, ορισμένα μόρια νερού κοντά στον πυθμένα αποκτούν αρκετή ενέργεια για να μεταβούν στη φάση των ατμών. Σχηματίζονται περιοχές με αέριο νερό, οι οποίες υποδεικνύονται από τεράστιες φυσαλίδες που ανεβαίνουν από τον πυθμένα. Επίσης, λόγω της έντονης κίνησης των μορίων, η συναγωγή θέρμανση ανεβάζει περαιτέρω τη θερμοκρασία. Στους 100oC, σχεδόν όλα τα μόρια του νερού έχουν επαρκή κινητική ενέργεια για να μεταβούν στη φάση των ατμών και οι φυσαλίδες υδρατμών θα αρχίσουν να ανεβαίνουν γρήγορα!




