Ορισμός Triple Point – Triple Point of Water
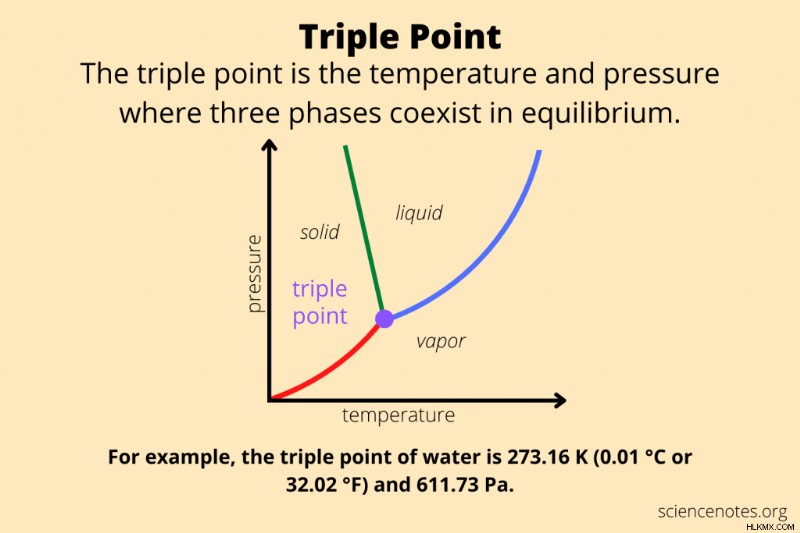
Στη χημεία και τη φυσική, τοτριπλό σημείο μιας καθαρής ουσίας είναι ο συνδυασμός θερμοκρασίας και πίεσης όπου υπάρχουν τρεις φάσεις σε θερμοδυναμική ισορροπία. Συνήθως, το τριπλό σημείο αναφέρεται στο σημείο όπου η στερεή, η υγρή και η αέρια φάση μιας ουσίας συνυπάρχουν σε ισορροπία. Ωστόσο, ο όρος ισχύει επίσης για τη θερμοκρασία και την πίεση στην οποία συνυπάρχουν οποιεσδήποτε τρεις φάσεις. Έτσι, εάν μια ουσία έχει πολλές στερεές φάσεις (κρυσταλλικές δομές), έχει πολλαπλές τιμές τριπλού σημείου.
Τριπλό σημείο νερού
Οι άνθρωποι συχνά αναφέρονται στη θερμοκρασία τριπλού σημείου του νερού, αλλά το τριπλό σημείο είναι πραγματικά ένας συνδυασμός θερμοκρασίας και πίεσης. Το τριπλό σημείο του νερού είναι στους 273,16 Kelvin (0,01 °C ή 32,02 °F) και πίεση 611,7 pascals (6,117 millibar, 0,0060373057 atm). (Ορισμένες πηγές αναφέρουν πίεση 611,73 Pa, ενώ άλλες αναφέρουν πίεση 611,657 Pa.) Σε αυτό το σημείο, πάγος, νερό και υδρατμοί συνυπάρχουν σε σταθερή μορφή. Η παραμικρή αλλαγή στη θερμοκρασία ή την πίεση προκαλεί το νερό να αλλάζει μορφή μεταξύ πάγου, υγρού νερού και υδρατμών.
Σημειώστε ότι η συνολική πίεση του συστήματος μπορεί να είναι πολύ πάνω από την πίεση του τριπλού σημείου, με την προϋπόθεση ότι η μερική πίεση του νερού είναι στα 611 Pa. Σημειώστε επίσης ότι το τριπλό σημείο αντιστοιχεί στη χαμηλότερη πίεση κάτω από την οποία υπάρχει υγρό νερό. Κάτω από αυτήν την πίεση, ο πάγος μετατρέπεται απευθείας σε ατμό και ο ατμός υφίσταται εξάχνωση σε πάγο.
Συνήθως, το τριπλό σημείο είναι η ελάχιστη θερμοκρασία στην οποία μπορεί να υπάρχει η υγρή μορφή μιας ουσίας. Το νερό είναι ασυνήθιστο από αυτή την άποψη λόγω του τρόπου με τον οποίο το σημείο τήξης του μειώνεται ως συνάρτηση της πίεσης (τουλάχιστον για τον εξαγωνικό πάγο).
Πίνακας τιμών τριπλών σημείων για κοινές ουσίες
Αυτός ο πίνακας παραθέτει τιμές τριπλών σημείων για πολλές καθαρές ουσίες. Τα περισσότερα από τα δεδομένα προέρχονται από το NIST (Εθνικό Ινστιτούτο Προτύπων και Τεχνολογίας των ΗΠΑ), με τιμές ηλίου από τους Donner et al. και Hoffer et al. Οι τιμές τριπλών πόντων συνήθως προέρχονται από την εξέταση δειγμάτων με καθαρότητα «έξι εννιά». Με άλλα λόγια, τα δείγματα είναι 99,9999% καθαρά.
| Ουσίες | Θερμοκρασία K (°C) | Πίεση kPa (atm) |
|---|---|---|
| Ακετυλένιο | 192,4 K (−80,7 °C) | 120 kPa (1,2 atm) |
| Αμμωνία | 195,40 K (−77,75 °C) | 6,060 kPa (0,05981 atm) |
| Αργόν | 83,8058 K (−189,3442 °C) | 68,9 kPa (0,680 atm) |
| Αρσενικό | 1.090 K (820 °C) | 3.628 kPa (35,81 atm) |
| Βουτάνιο | 134,6 K (−138,6 °C) | 7×10 kPa (6,9×10 atm) |
| Άνθρακας (γραφίτης) | 4.765 K (4.492 °C) | 10.132 kPa (100,00 atm) |
| Διοξείδιο του άνθρακα | 216,55 K (−56,60 °C) | 517 kPa (5,10 atm) |
| Μονοξείδιο του άνθρακα | 68,10 K (−205,05 °C) | 15,37 kPa (0,1517 atm) |
| Χλωροφόρμιο | 175,43 K (−97,72 °C) | 0,870 kPa (0,00859 atm) |
| Δευτέριο | 18,63 K (−254,52 °C) | 17,1 kPa (0,169 atm) |
| Αιθάνιο | 89,89 K (−183,26 °C) | 1,1×10 kPa (1,1×10 atm) |
| Αιθανόλη | 150 K (−123 °C) | 4,3×10 kPa (4,2×10 atm) |
| Αιθυλένιο | 104,0 K (−169,2 °C) | 0,12 kPa (0,0012 atm) |
| Μυρμηκικό οξύ | 281,40 K (8,25 °C) | 2,2 kPa (0,022 atm) |
| Ηλιο-4 (σημείο λάμδα) | 2,1768 K (−270,9732 °C) | 5,048 kPa (0,04982 atm) |
| Ηλιο-4 (hcp-bcc-He-II) | 1,463 K (−271,687 °C) | 26,036 kPa (0,25696 atm) |
| Ηλιο-4 (bcc-He-1-He-II) | 1,762 K (−271,388 °C) | 29,725 kPa (0,29336 atm) |
| Ηλιο-4 (hcp-bcc-He-1) | 1,772 K (−271,378 °C) | 30,016 kPa (0,29623 atm) |
| Εξαφθοροαιθάνιο | 173,08 K (−100,07 °C) | 26,60 kPa (0,2625 atm) |
| Υδρογόνο | 13,8033 K (−259,3467 °C) | 7,04 kPa (0,0695 atm) |
| Υδροχλώριο | 158,96 K (−114,19 °C) | 13,9 kPa (0,137 atm) |
| Ιώδιο | 386,65 K (113,50 °C) | 12,07 kPa (0,1191 atm) |
| Ισοβουτάνιο | 113,55 K (−159,60 °C) | 1,9481×10 kPa (1,9226×10 atm) |
| Krypton | 115,76 K (−157,39 °C) | 74,12 kPa (0,7315 atm) |
| Ερμής | 234,3156 K (−38,8344 °C) | 1,65×10 kPa (1,63×10 atm) |
| Μεθάνιο | 90,68 K (−182,47 °C) | 11,7 kPa (0,115 atm) |
| Νέον | 24,5561 K (−248,5939 °C) | 43,332 kPa (0,42765 atm) |
| Οξείδιο του αζώτου | 109,50 K (−163,65 °C) | 21,92 kPa (0,2163 atm) |
| Άζωτο | 63,18 K (−209,97 °C) | 12,6 kPa (0,124 atm) |
| Οξείδιο του αζώτου | 182,34 K (−90,81 °C) | 87,85 kPa (0,8670 atm) |
| Οξυγόνο | 54,3584 K (−218,7916 °C) | 0,14625 kPa (0,0014434 atm) |
| Παλλάδιο | 1.825 K (1.552 °C) | 3,5×10 kPa (3,5×10 atm) |
| Πλατινένιο | 2.045 K (1.772 °C) | 2×10 kPa (2,0×10 atm) |
| Ραδόνιο | 202 K (−71 °C) | 70 kPa (0,69 atm) |
| Διοξείδιο του θείου | 197,69 K (−75,46 °C) | 1,67 kPa (0,0165 atm) |
| Τιτάνιο | 1.941 K (1.668 °C) | 5,3×10 kPa (5,2×10 atm) |
| Εξαφθοριούχο ουράνιο | 337,17 K (64,02 °C) | 151,7 kPa (1,497 atm) |
| Νερό | 273,16 K (0,01 °C) | 0,611657 kPa (0,00603659 atm) |
| Xenon | 161,3 K (−111,8 °C) | 81,5 kPa (0,804 atm) |
| Ψευδάργυρος | 692,65 K (419,50 °C) | 0,065 kPa (0,00064 atm) |
Υπάρχει μόνο ένα τριπλό σημείο;
Οι περισσότερες ουσίες έχουν περισσότερα από ένα τριπλά σημεία επειδή το στερεό τους λαμβάνει διαφορετικές μορφές ή αλλοτρόπα. Αν υπάρχουν p φάσεις της ύλης, ο αριθμός των τριπλών σημείων είναι p!/(p-3)!3!
Για παράδειγμα, εάν το στερεό θείο έχει δύο στερεές φάσεις (ρομβική και μονοκλινική), μια υγρή φάση και μια φάση ατμού, ο αριθμός των τριπλών σημείων του είναι 4!/(4-3)!3!.
αριθμός τριπλών πόντων =24 / (1)(6) =4
Το νερό έχει 15 γνωστές φάσεις πάγου και εκατοντάδες τριπλούς πόντους! Τουλάχιστον 10 από αυτές τις τιμές είναι γνωστές. Η συνήθης μεμονωμένη τιμή που βλέπετε είναι για τον εξαγωνικό πάγο. Οι άλλες μορφές πάγου εμφανίζονται σε πολύ χαμηλή θερμοκρασία ή πολύ υψηλές πιέσεις.
Triple Point vs Critical Point
Το τριπλό σημείο και το κρίσιμο σημείο μιας ουσίας συχνά συγχέονται, αλλά οι δύο όροι έχουν διαφορετική σημασία. Το τριπλό σημείο είναι η θερμοκρασία και η πίεση στην οποία υπάρχουν τρεις καταστάσεις της ύλης σε ισορροπία. Το κρίσιμο σημείο είναι επίσης ένας συνδυασμός θερμοκρασίας και πίεσης, αλλά είναι το τελικό σημείο μιας καμπύλης ισορροπίας φάσης όπου ένα υγρό και ο ατμός του μπορούν να συνυπάρξουν. Το κρίσιμο σημείο υποδεικνύει την υψηλότερη θερμοκρασία όπου η ουσία γίνεται υπερκρίσιμο ρευστό και δεν μπορεί να συμπυκνωθεί σε υγρό μόνο με πίεση. Στο κρίσιμο σημείο, οι φυσικές ιδιότητες της φάσης υγρού και ατμού γίνονται παρόμοιες μεταξύ τους και μερικές φορές πολύ διαφορετικές από την κανονική συμπεριφορά του υγρού.
Το κρίσιμο σημείο για το νερό είναι 647.096 K (373.946 °C, 705.103 °F) και 22.064 megapascals (3.200,1 psi, 217,75 atm). Αυτή είναι μια υψηλότερη θερμοκρασία και πίεση από το τριπλό σημείο του νερού. Κοντά στο κρίσιμο σημείο, το υγρό νερό γίνεται συμπιεστικό, φτωχό διηλεκτρικό και φτωχός διαλύτης για τους ηλεκτρολύτες. Αυτές οι ιδιότητες είναι αντίθετες από τις κανονικές ιδιότητες του νερού.
Αναφορές
- Cengel, Yunus A.; Turner, Robert H. (2004). Βασικές αρχές των Θερμικών-Ρευστών Επιστημών . Βοστώνη:McGraw-Hill. ISBN 0-07-297675-6.
- Donnelly, Russell J.; Barenghi, Carlo F. (1998). «Οι παρατηρούμενες ιδιότητες του υγρού ηλίου στην πίεση κορεσμένων ατμών». Journal of Physical and Chemical Reference Data . 27 (6):1217–1274. doi:10.1063/1.556028
- Hoffer, J. K.; Gardner, W. R.; Waterfield, C. G.; Phillips, Ν. Ε. (Απρίλιος 1976). «Θερμοδυναμικές ιδιότητες του 4He. II. Η φάση bcc και τα διαγράμματα φάσης P-T και VT κάτω από 2 K”. Journal of Low Temperature Physics . 23 (1):63–102. doi:10.1007/BF00117245
- IUPAC (1997). «Τριπλό σημείο». Σύνοψη Χημικής Ορολογίας (το «Χρυσό Βιβλίο») (2η έκδ.). Blackwell Scientific. doi:10.1351/goldbook.T06502
- Murphy, D. M. (2005). «Επισκόπηση των πιέσεων ατμών του πάγου και του υπερψυκτικού νερού για ατμοσφαιρικές εφαρμογές». Quarterly Journal of the Royal Meteorological Society . 131 (608):1539–1565. doi:10.1256/qj.04.94
- Papon, P.; Leblond, J.; Meijer, P. H. E. (2002). Η Φυσική της Μετάβασης Φάσης:Έννοιες και Εφαρμογές . Βερολίνο:Springer. ISBN 978-3-540-43236-4.