Συνήθεις ερωτήσεις σχετικά με τη δοκιμή βρωμίου νερού
Το βρωμιούχο νερό, κοινώς γνωστό ως διάλυμα βρωμιούχου βρωμιούχου, είναι μια χημική ένωση που έχει ο τύπος Br2. Το βρωμιούχο νερό έχει μοριακή μάζα 159,81 και πυκνότητα 1,307 g/mL.
Το βρωμιούχο νερό είναι απλώς ένα κίτρινο μεικτό διάλυμα με ισχυρή ικανότητα οξείδωσης λόγω ο συνδυασμός διατομικού βρωμίου (Br2) και νερού (H2O). Μπορούμε να χρησιμοποιήσουμε τη διαδικασία αλογόνωσης για να ανιχνεύσουμε τη λειτουργική ομάδα που υπάρχει μέσα σε οργανικά μόρια χρησιμοποιώντας βρωμιούχο νερό.
Δοκιμή βρωμίου νερού (κορεσμός)
Η δοκιμή βρωμίου νερού είναι μια σημαντική μέθοδος για τον προσδιορισμό της παρουσίας οποιουδήποτε αλκενίου/ λειτουργικές ομάδες αλκανίων σε μια χημική ουσία.
Ομάδες αλκενίων αντιδρούν στο βρώμιο νερό, κυρίως στο σκοτάδι, και διεξάγουν αντίδραση προσθήκης, με αποτέλεσμα ένα αποχρωματισμένο διάλυμα. Τα αλκάνια, αντίθετα, δεν αλληλεπιδρούν με το βρωμιούχο νερό, επομένως το χρώμα του βρωμιούχου νερού δεν αλλάζει.
Οι πιο κοινές ουσίες που ελέγχονται σε βρωμιούχο νερό περιλαμβάνουν ενόλες, ανιλίνες, αλκένια, φαινόλες, ομάδες ακετυλίου και γλυκόζη.
Αυτή η δοκιμή προσδιορίζει επίσης εάν η ουσία έχει μια λειτουργική ομάδα αλδεΰδης. Το χρώμα του υγρού βρωμίου αλλάζει από κίτρινο σε ουδέτερο εάν υπάρχει μια λειτουργική ομάδα αλδεΰδης.
Αντιδράσεις με διάφορες λειτουργικές ομάδες
Αλκένιο
Ένας τύπος αντίδρασης γνωστός ως αντίδραση προσθήκης είναι η αντίδραση που περιλαμβάνει βρώμιο και αλκένια. Αναπτύσσεται ένα άχρωμο διβρωμομόριο, το οποίο αποχρωματίζει το βρώμιο. Παράδειγμα:
αιθένιο + βρώμιο → διβρωμοαιθάνιο
C2H4 + Br2 → C2H4Br2
Άλλες διαδικασίες προσθήκης αλκενίου περιλαμβάνουν συμπερίληψη υδρογόνου σε κάτι σαν διπλό C=C δεσμός. Αναγκάζει το μόριο να «κορεσθεί», μετατρέποντας ένα αλκένιο σε αλκάνιο.
C2H4 + H2 → C2H6
Όταν εισάγουμε ατμό σε ένα αλκένιο, σχηματίζει αλκοόλη.
C2H4 + H2O → C2H5OH
Αλκάνια
Τα αλκάνια είναι μια ομάδα υδρογονανθράκων που είναι όλοι ίδιοι. Σημαίνει ότι τα χημικά τους χαρακτηριστικά είναι συγκρίσιμα και οι φυσικές τους ιδιότητες κινούνται προς την ίδια κατεύθυνση. Το σημείο βρασμού μιας αλυσίδας, για παράδειγμα, αυξάνεται όταν το μήκος της αλυσίδας μεγαλώνει.
Ο γενικός τύπος δηλώνει ότι ένα αλκάνιο έχει διπλάσια ποσότητα μορίων άνθρακα και δύο υδρογόνα. Το μεθάνιο, για παράδειγμα, είναι CH4, ενώ το αιθάνιο είναι C2H6.
Τα αλκάνια φαίνεται να είναι υδρογονάνθρακες που είναι κορεσμένοι. Δείχνει ότι τα άτομα άνθρακα παραμένουν συνδεδεμένα με απλούς δεσμούς. Εκτός από την αλληλεπίδρασή τους με το οξυγόνο στην ατμόσφαιρα, την οποία ονομάζουμε καύση ή καύση, είναι γενικά σχετικά αδρανείς.
Στο ηλιακό φως, τα αλκάνια διεξάγουν μια αντίδραση υποκατάστασης που περιλαμβάνει αλογόνα.
Το μεθάνιο, για παράδειγμα, αλληλεπιδρά με άτομα αλογόνου όπως το χλώριο και το βρώμιο όταν εκτίθεται σε υπεριώδη ακτινοβολία.
μεθάνιο + βρώμιο → μεθυλοβρωμίδιο + υδροβρωμίδιο
CH4 + Br2 → CH3Br + HBr
Ανιλίνες
Το βρώμιο νερό αλληλεπιδρά με την ανιλίνη ή τη φαινυλαμίνη. Η αντίδραση έχει ως αποτέλεσμα το σχηματισμό ενός λευκού ιζήματος και τον αποχρωματισμό του διαλύματος βρωμίου.
NH2 + 3Br2 → 3HBr
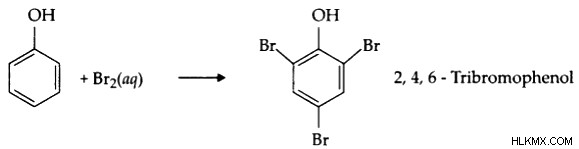
Φαινόλες
Με την προσθήκη βρωμιούχου νερού, οι φαινολικές ενώσεις διεξάγουν αντιδράσεις υποκατάστασης, αποδίδοντας βρωμιούχο προϊόν. Το υγρό βρωμίου αποχρωματίζεται καθ' όλη τη διάρκεια της διαδικασίας, με αποτέλεσμα ένα λευκό ίζημα.
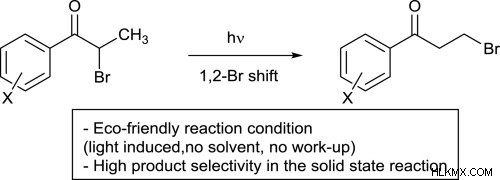
Κετόνες
Το φαινόμενο ηλεκτροφιλικής υποκατάστασης άλφα προχωρά μεταξύ της αντίδρασης κετόνης με βρώμιο νερό κοντά στο καρβονυλική ομάδα. Αποδίδει ένα διαυγές διάλυμα που περιέχει βρωμιωμένα μόρια.
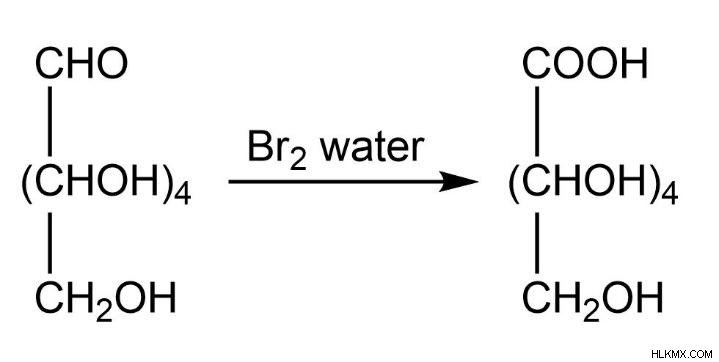
Γλυκόζη
Η δοκιμή βρωμίου νερού είναι ένας αποτελεσματικός και εύκολος τρόπος για να πούμε τη διαφορά μεταξύ της φρουκτόζης και γλυκόζη.
Όταν η γλυκόζη αντιδρά στο βρώμιο νερό, διεξάγει μια διαδικασία οξείδωσης, δίνοντας γλυκουρονικό οξέα. Η φρουκτόζη δεν ξεκινά μια διαδικασία οξείδωσης επειδή το βρωμιούχο νερό είναι απλώς ένας μέτριας έντασης οξειδωτικός παράγοντας.
Αλδεΰδες
Όταν μια αλδεΰδη αλληλεπιδρά με νερό βρωμίου, προχωρά ένα φαινόμενο οξείδωσης, με αποτέλεσμα ο σχηματισμός άχρωμου διαλύματος.
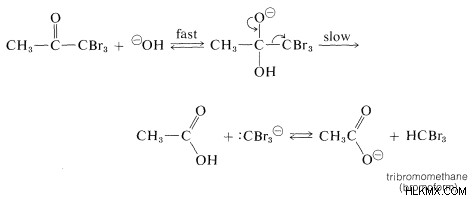
Εφαρμογές βρωμίου νερού
Το βρωμιούχο νερό έχει διάφορες εφαρμογές, συγκεκριμένα:
Πύργος ψύξης και νερό ψύξης
Επεξεργασία πουλερικών
Πισίνες και σπα
Λύματα
Εφαρμογές πετρελαίου και φυσικού αερίου
Ζυθοποιία
Συμπέρασμα
Η δοκιμή βρωμίου νερού είναι χρήσιμη για να προσδιοριστεί εάν οι υδρογονάνθρακες είναι κορεσμένοι ή ακόρεστοι. Οι δοκιμές βρωμίου νερού είναι εύκολο να πραγματοποιηθούν σε οργανικές ουσίες, συμπεριλαμβανομένων των φαινολών, των ενώσεων ακετυλίου, των αλκενίων και ακόμη και των ανιλινών.
Μια αλλαγή χρώματος στο βρωμιούχο νερό κατά τη διάρκεια της διαδικασίας υποδηλώνει την ύπαρξη ακόρεστη ομάδα (κυρίως οργανικά μόρια).
Επιπλέον, χρησιμοποιούμε συνήθως βρωμιούχο νερό για να ανιχνεύσουμε την παρουσία ενός αλκενίου με ο διπλός ομοιοπολικός σύνδεσμος, ο οποίος αλληλεπιδρά με το βρωμιούχο νερό για να αλλάξει το χρώμα του από έντονο κίτρινο σε κάτι άχρωμο.
Το βρωμιούχο νερό χρησιμοποιείται επίσης ευρέως για να προσδιοριστεί εάν μια χημική ουσία περιέχει ομάδα αλδεΰδης .