Περιοριστικό αντιδραστήριο και περιοριστικό αντιδραστήριο
Βασικές έννοιες – Περιοριστικό αντιδραστήριο:
Σε αυτό το σεμινάριο, θα μάθετε τι είναι ένα περιοριστικό αντιδραστήριο, πώς να βρείτε το περιοριστικό αντιδραστήριο και θα δείτε μερικά παραδείγματα προβλημάτων.
Τι είναι ένα Περιοριστικό Αντιδραστήριο;
Το περιοριστικό αντιδραστήριο είναι το αντιδραστήριο (ένωση ή στοιχείο) που πρέπει να καταναλωθεί πλήρως σε μια χημική αντίδραση. Ο περιορισμός του αντιδραστηρίου είναι επίσης αυτό που εμποδίζει τη συνέχιση μιας αντίδρασης επειδή δεν υπάρχει κανένα άλλο. Το περιοριστικό αντιδραστήριο μπορεί επίσης να αναφέρεται ως περιοριστικό αντιδραστήριο ή περιοριστικός παράγοντας. Το αντιδραστήριο που δεν έχει εξαντληθεί αναφέρεται ως η περίσσεια αντιδραστηρίου.
Για παράδειγμα, σκεφτείτε αν προσπαθείτε να φτιάξετε ένα μπιφτέκι που έχει δύο κομμάτια ψωμί, ένα κομμάτι ντομάτα και ένα κομμάτι κρέας. Η αντίδραση θα ήταν
1 ντομάτα + 1 κρέας + 2 ψωμί –> 1 μπιφτέκι
Έχετε 3 κομμάτια ντομάτα, 2 κομμάτια κρέας και 6 κομμάτια ψωμί.
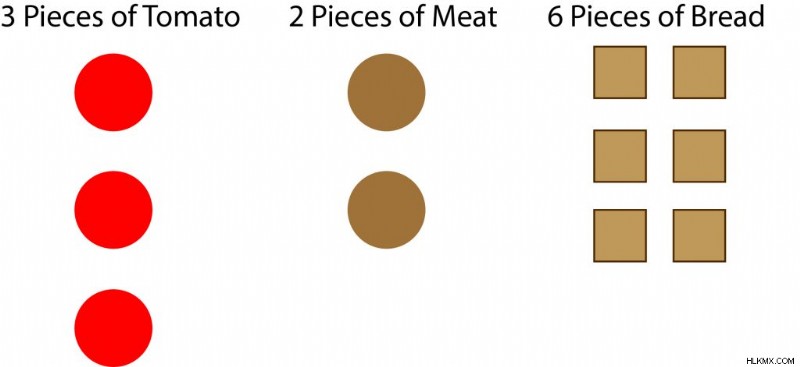
Όταν συνδυάζονται για να φτιάξουν σάντουιτς, το πρώτο συστατικό που τελειώνει είναι το κρέας. Έχετε αρκετό κρέας για να φτιάξετε δύο μπιφτέκια, αλλά αρκετή ντομάτα και ψωμί για να φτιάξετε τρία μπιφτέκια. Επομένως, το κρέας είναι το περιοριστικό αντιδραστήριο. Το κρέας είναι το πρώτο συστατικό που καταναλώνεται. Το ψωμί και η ντομάτα έχουν περίσσεια και γι' αυτό ονομάζονται περίσσεια αντιδρώντος. Η ίδια ιδέα ισχύει για τις χημικές αντιδράσεις.
Είναι σημαντικό να μπορούμε να βρούμε το περιοριστικό αντιδραστήριο γιατί δεν μπορούμε πάντα να προσθέτουμε ακριβώς τον αριθμό των μορίων που θέλουμε για να εξισορροπήσουμε τέλεια τις εξισώσεις μας. Συχνά, ένα αντιδραστήριο προστίθεται υπερβολικά επειδή είναι φθηνότερο και βεβαιωθείτε ότι το πιο ακριβό αντιδραστήριο έχει εξαντληθεί πλήρως.
Από το περιοριστικό αντιδραστήριο, μπορεί επίσης να υπολογιστεί η θεωρητική απόδοση. Η θεωρητική απόδοση είναι η μέγιστη ποσότητα προϊόντος που μπορεί να σχηματιστεί από το περιοριστικό αντιδραστήριο. Ωστόσο, η πραγματική απόδοση σε μια αντίδραση είναι σχεδόν πάντα μικρότερη από τη θεωρητική απόδοση. Αυτός είναι ο λόγος για τον οποίο η ποσοστιαία απόδοση υπολογίζεται για να συγκριθεί η θεωρητική απόδοση με την πραγματική απόδοση.
Πώς να βρείτε το περιοριστικό αντιδραστήριο
Υπάρχουν διάφοροι τρόποι εύρεσης του περιοριστικού αντιδραστηρίου. Ένα κλειδί είναι να ξεκινάτε πάντα με μια ισορροπημένη χημική αντίδραση. Είναι επίσης απαραίτητο να συγκρίνετε πάντα τις μολικές ποσότητες, όχι το βάρος (δηλ. γραμμάρια). Μόνο οι κρεατοελιές λειτουργούν για τον προσδιορισμό του περιοριστικού αντιδραστηρίου επειδή μας λέει πόσα μόρια υπάρχουν.
Μέθοδος 1 -Σύγκριση παραγόμενου προϊόντος
Για την επεξεργασία αυτής της μεθόδου θα εξετάσουμε την αντίδραση μεταξύ αζώτου και υδρογόνου για την παραγωγή αμμωνίας.
N2 + H2 –> NH3
- Ξεκινήστε με μια ισορροπημένη χημική εξίσωση
N2 + 3 H2 –> 2 NH3
2. Μετατρέψτε οποιαδήποτε ποσότητα δίνεται σε moles κάθε αντιδραστηρίου χρησιμοποιώντας στοιχειομετρία.

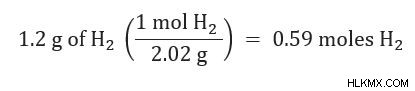
3. Για κάθε αντιδραστήριο, υπολογίστε πόσα mol προϊόντος θα παραχθούν.
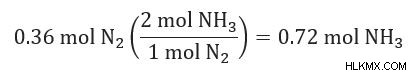
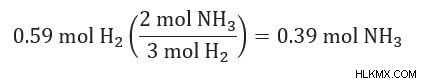
4. Το αντιδραστήριο που παράγει τη ΛΙΓΟΤΕΡΟ ποσότητα προϊόντος είναι το περιοριστικό σας αντιδραστήριο.
0,72 mol NH3 (από N2 )> 0,39 mol NH3 (από H2 )
Επομένως H2 είναι το περιοριστικό αντιδραστήριο
Διαθέσιμη μέθοδος 2-Σύγκριση αντιδραστηρίου
N2 + H2 –> NH3
- Ξεκινήστε με μια ισορροπημένη χημική εξίσωση
1 N2 + 3 H2 –> 2 NH3
2. Μετατρέψτε οποιαδήποτε ποσότητα δίνεται (για παράδειγμα σε γραμμάρια) σε mole κάθε αντιδραστηρίου.
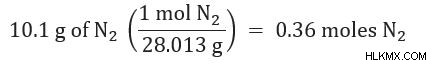
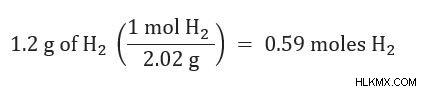
3. Χρησιμοποιώντας την αναλογία mole, μετατρέψτε πόση ποσότητα προϊόντος Α έχετε στην ποσότητα προϊόντος Β που θα χρειαζόταν.
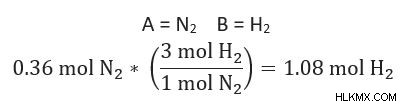
4. Εάν η υπολογιζόμενη ποσότητα του Β είναι μεγαλύτερη από την πραγματική ποσότητα του Β, αυτό σημαίνει ότι το Β είναι το περιοριστικό αντιδραστήριο. Εάν η υπολογιζόμενη ποσότητα είναι μικρότερη από την πραγματική ποσότητα από το Β ΔΕΝ είναι το περιοριστικό αντιδραστήριο.
Η υπολογιζόμενη ποσότητα B =1,08 mole H2
Η πραγματική ποσότητα B =0,59 mole H2
Επειδή 1,08 mole> 0,59 mole H2 γνωρίζουμε το H2 ΕΙΝΑΙ το περιοριστικό αντιδραστήριο στην παραγωγή αμμωνίας σε αυτό το πρόβλημα.
Παρατηρήστε ότι κάθε μέθοδος ξεκινά με την εξισορρόπηση της χημικής εξίσωσης και, στη συνέχεια, τη μετατροπή όλων των ποσών σε mole. Στη συνέχεια, συγκρίνετε τις μοριακές αναλογίες είτε του προϊόντος που σχηματίστηκε είτε της ποσότητας αντιδραστηρίου που θα απαιτηθεί.
Παράδειγμα προβλήματος του τρόπου εύρεσης του περιοριστικού αντιδραστηρίου
Πρόβλημα:Έχετε 0,4 g H2 και 1,8 g O2 να κάνει νερό. Ποιο είναι το περιοριστικό αντιδραστήριο στην παραγωγή νερού;
Λύση:
Ξεκινήστε εξισορροπώντας τη χημική αντίδραση.
2 H2 + 1 O2 –> 2 H2 O
Μετατρέψτε τις ποσότητες που δίνονται σε γραμμάρια σε κρεατοελιές.
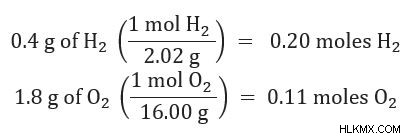
Υπολογίστε την ποσότητα του προϊόντος που παράγεται από κάθε αντιδραστήριο
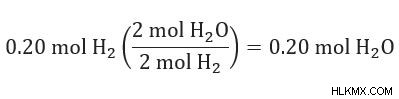
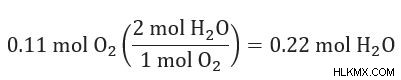
Συγκρίνετε την ποσότητα του προϊόντος που παράγεται για να δείτε ποια είναι η μικρότερη ποσότητα.
Το παραπάνω αποτέλεσμα δείχνει ότι το οξυγόνο (O2 ) παράγει περισσότερο νερό (H2 O) από το υδρογόνο (H2 ). Επομένως, το υδρογόνο είναι το περιοριστικό αντιδραστήριο.




