Χωρητικότητα buffer:Ορισμός και μέθοδος υπολογισμού
Η ρυθμιστική ικανότητα είναι ένα μέτρο της αντοχής ενός συγκεκριμένου διαλύματος στην αλλαγή του pH όταν προστίθεται ένα οξύ ή μια βάση σε αυτό.
Εάν θυμάστε τη χημεία του γυμνασίου ή παρακολουθήσατε ένα μάθημα κολεγίου όπως το Chemistry 101, θα έχετε πραγματοποιήσει μια δοκιμασία τιτλοδότησης. Προσωπικά, την πρώτη φορά που άφησα το υγρό να διεισδύσει στον πάτο της γυάλινης φιάλης, περιμένοντας υπομονετικά να γίνει το διάλυμα σε μια απόχρωση ροζ ή ματζέντα, ειλικρινά με έκανε να νιώσω επιστήμονας! Ωστόσο, γιατί αυτό το διάλυμα αλλάζει χρώμα μόνο όταν προστίθεται μια ορισμένη ποσότητα χημικών ουσιών; Για να λάβουμε αυτήν την απάντηση, πρέπει να κατανοήσουμε τις εγγενείς ιδιότητες της λύσης.
(Πίστωση εικόνας:Pixabay)
Χωρητικότητα buffer:Ορισμός
Πριν μάθουμε τι είναι η χωρητικότητα buffer, θα πρέπει πρώτα να κατανοήσουμε τα buffer. Ένα buffer είναι μια ένωση που αντιστέκεται στις αλλαγές του pH όταν προστίθεται σε αυτήν περιορισμένη ποσότητα οξέος ή βάσης. Η χημική σύνθεση ενός ρυθμιστικού διαλύματος συνήθως περιλαμβάνει ένα ασθενές οξύ ή μια ασθενή βάση που συνοδεύεται από το συζυγές άλας του.
Τώρα, Χωρητικότητα προσωρινής αποθήκευσης μπορεί να οριστεί ως το μέτρο της αποτελεσματικότητας ενός ρυθμιστικού διαλύματος στην αντίσταση στην αλλαγή του στο pH. Αυτός ο ορισμός παρουσιάζει λίγο πρόβλημα ως προς το «ποια είναι η σημαντική αλλαγή;» Μερικές φορές, μια αλλαγή 1 μονάδας δεν επιφέρει καμία σημαντική αλλαγή. Σε άλλες περιπτώσεις, ακόμη και μια αλλαγή 0,1 μονάδων μπορεί να προκαλέσει σημαντική διαφορά. Έτσι, για να δοθεί ένας πιο σαφής ορισμός, η χωρητικότητα του ρυθμιστικού διαλύματος μπορεί να οριστεί ως η ποσότητα ενός ισχυρού οξέος ή μιας ισχυρής βάσης που πρέπει να προστεθεί σε ένα λίτρο διαλύματος για να το αλλάξει κατά μία μονάδα pH. Η εξίσωση χωρητικότητας buffer είναι η εξής: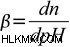 όπου n είναι μερικά ισοδύναμα της προστιθέμενης ισχυρής βάσης (ανά 1 λίτρο του διαλύματος). Σημειώστε ότι η προσθήκη n moles οξέος θα αλλάξει το pH κατά την ίδια τιμή, αλλά προς την αντίθετη κατεύθυνση. Θα εξαγάγουμε έναν τύπο που συνδέει την χωρητικότητα του ρυθμιστικού διαλύματος με το pH, το pKa και τη συγκέντρωση του ρυθμιστικού διαλύματος.
όπου n είναι μερικά ισοδύναμα της προστιθέμενης ισχυρής βάσης (ανά 1 λίτρο του διαλύματος). Σημειώστε ότι η προσθήκη n moles οξέος θα αλλάξει το pH κατά την ίδια τιμή, αλλά προς την αντίθετη κατεύθυνση. Θα εξαγάγουμε έναν τύπο που συνδέει την χωρητικότητα του ρυθμιστικού διαλύματος με το pH, το pKa και τη συγκέντρωση του ρυθμιστικού διαλύματος.
Υπολογισμός χωρητικότητας buffer
Τώρα που είδαμε πώς μπορεί να γραφτεί η εξίσωση προσωρινής αποθήκευσης, ας προσπαθήσουμε να την εξάγουμε για να έχουμε καλύτερη κατανόηση του πώς φτάσαμε στην παραπάνω εξίσωση. Για να κάνουμε αυτή την παραγωγή λίγο πιο εύκολη, θα κάνουμε τη βάση μονοπρωτική (μια βάση που δέχεται μόνο ένα πρωτόνιο). Θα υποθέσουμε επίσης ότι ο όγκος είναι ένας, καθώς αυτό μας βοηθά να αντιμετωπίζουμε τη συγκέντρωση και τον αριθμό των σπίλων εναλλακτικά. Το υπόλοιπο φορτίου της λύσης που υποθέτουμε αποδεικνύεται από την ακόλουθη εξίσωση:
[A–]+[OH+]=[B+]+[H+]
Το [B+] υποδηλώνει την παρουσία ισχυρής συγκέντρωσης βάσης στο διάλυμα. Το [B+] είναι επίσης το n υπάρχει στην πρώτη εξίσωση χωρητικότητας προσωρινής αποθήκευσης. Τώρα η συνολική συγκέντρωση του ρυθμιστικού διαλύματος δίνεται από την ακόλουθη εξίσωση:
Cbuff =[HA]+[A–]
Το [AH] στην παραπάνω εξίσωση μπορεί να αναλυθεί σε μικρότερα συστατικά στοιχεία. Αυτή η διάσπαση μιας μεγαλύτερης, πιο σύνθετης ένωσης σε μικρότερα βασικά στοιχεία είναι γνωστή ως σταθερά διάστασης. Η σταθερά διάστασης βοηθά στην ευκολότερη απλοποίηση της παραγωγής. Το Ka στην παρακάτω εξίσωση είναι η σταθερά διάστασης οξέος. Σχετίζεται με το πόσο εύκολα ένα μόριο θα λειτουργήσει ως οξύ.
[HA]=([H+][A–])/Ka
Τώρα, η παραπάνω εξίσωση μπορεί να αντικατασταθεί στην εξίσωση συμπυκνώματος buffer, δίνοντας την ακόλουθη εξίσωση:
Cbuff=([H+][A–])/Ka + [A–]
Τώρα, αν λαμβάναμε το [A–] ως κοινό παράγοντα και το LCM για να απλοποιήσουμε την παραπάνω εξίσωση, θα λαμβάναμε την ακόλουθη εξίσωση:
[A–]=(Cbuff+Ka)/(Ka+H+)
Πριν προχωρήσουμε προς τα εμπρός, πρέπει να κατανοήσουμε έναν κρίσιμο ορισμό που θα χρησιμεύσει ως προϋπόθεση για να τυλίξουμε σωστά αυτήν την παράγωγη, γνωστή ως σταθερά ιονισμού νερού ή τοναυτοιονισμό του νερού . Οαυτοιονισμός του νερού είναι μια αντίδραση ιονισμού που συμβαίνει σε καθαρό νερό ή σε υδατικό διάλυμα, κατά την οποία το H2O χάνει τον πυρήνα ενός από τα άτομα υδρογόνου του για να γίνει ιόν υδροξειδίου, OH−.

(Φωτογραφία:Manuel Almagro Rivas/Wikimedia Commons)
Τώρα, χρησιμοποιώντας την εξίσωση ισοζυγίου φορτίου, το ισοδύναμο [A–] και τη σταθερά ιονισμού νερού, μπορούμε να καταλήξουμε στην ακόλουθη εξίσωση:
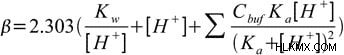 Οι δύο πρώτοι όροι που υπάρχουν στην εξίσωση δεν εξαρτώνται από το buffer στη λύση. Αντιπροσωπεύουν το γεγονός ότι το διάλυμα υψηλού (ή χαμηλού) pH είναι ανθεκτικό στις αλλαγές του pH. Αυτό υποδεικνύει ότι ορισμένα διαλύματα με άκρα σε pH είναι ανθεκτικά στις αλλαγές, ακόμη και χωρίς να υπάρχει ρυθμιστικό διάλυμα.
Οι δύο πρώτοι όροι που υπάρχουν στην εξίσωση δεν εξαρτώνται από το buffer στη λύση. Αντιπροσωπεύουν το γεγονός ότι το διάλυμα υψηλού (ή χαμηλού) pH είναι ανθεκτικό στις αλλαγές του pH. Αυτό υποδεικνύει ότι ορισμένα διαλύματα με άκρα σε pH είναι ανθεκτικά στις αλλαγές, ακόμη και χωρίς να υπάρχει ρυθμιστικό διάλυμα.
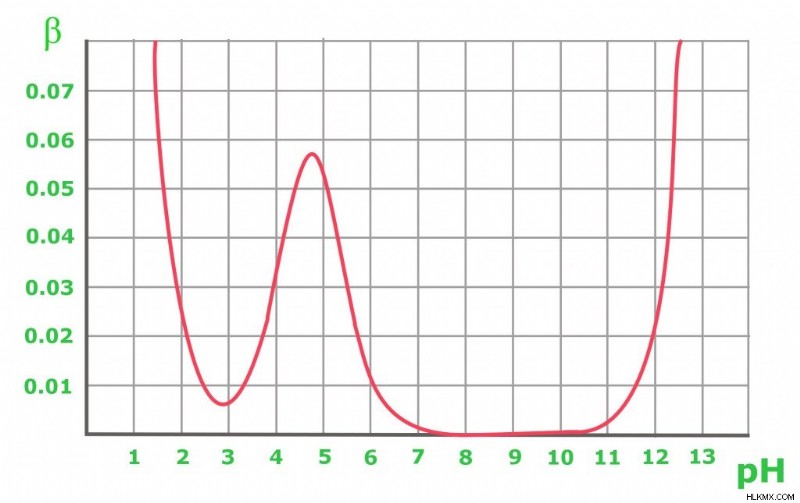 Το παραπάνω γράφημα δείχνει τις αλλαγές χωρητικότητας buffer σε 0,1 M ενός οξικού buffer. Όπως αναμενόταν, το ρυθμιστικό αντιστέκεται στην προσθήκη οξέος και βάσης για να διατηρήσει ένα ισομοριακό διάλυμα (όταν pH=pKa). Από το γράφημα, είναι προφανές ότι η χωρητικότητα του ρυθμιστικού διαλύματος έχει λογικά υψηλές τιμές μόνο για το pH κοντά στην τιμή pKa:όσο πιο μακριά από τη βέλτιστη τιμή, τόσο μικρότερη είναι η χωρητικότητα του ρυθμιστικού διαλύματος. Ένα διάλυμα που περιέχει μια συζυγή βάση pH 8-10 έχει ρυθμιστική ικανότητα μηδέν, ενώ για υψηλότερο pH, η παρουσία της ισχυρής βάσης αρχίζει να παίζει σημαντικό ρόλο. Στην περίπτωση διαλύματος καθαρού οξικού οξέος με pH κάτω του 3, το pH είναι ήδη αρκετά χαμηλό ώστε να είναι ανθεκτικό στις αλλαγές λόγω της υψηλής συγκέντρωσης κατιόντων Η+.
Το παραπάνω γράφημα δείχνει τις αλλαγές χωρητικότητας buffer σε 0,1 M ενός οξικού buffer. Όπως αναμενόταν, το ρυθμιστικό αντιστέκεται στην προσθήκη οξέος και βάσης για να διατηρήσει ένα ισομοριακό διάλυμα (όταν pH=pKa). Από το γράφημα, είναι προφανές ότι η χωρητικότητα του ρυθμιστικού διαλύματος έχει λογικά υψηλές τιμές μόνο για το pH κοντά στην τιμή pKa:όσο πιο μακριά από τη βέλτιστη τιμή, τόσο μικρότερη είναι η χωρητικότητα του ρυθμιστικού διαλύματος. Ένα διάλυμα που περιέχει μια συζυγή βάση pH 8-10 έχει ρυθμιστική ικανότητα μηδέν, ενώ για υψηλότερο pH, η παρουσία της ισχυρής βάσης αρχίζει να παίζει σημαντικό ρόλο. Στην περίπτωση διαλύματος καθαρού οξικού οξέος με pH κάτω του 3, το pH είναι ήδη αρκετά χαμηλό ώστε να είναι ανθεκτικό στις αλλαγές λόγω της υψηλής συγκέντρωσης κατιόντων Η+.




