Ορισμός και τάση Ηλεκτραρνητικότητας
Ηλεκτραρνητικότητα είναι ένα μέτρο του πόσο εύκολα ένα άτομο έλκει ένα ζεύγος ηλεκτρονίων για να σχηματίσει έναν χημικό δεσμό. Μια υψηλή τιμή ηλεκτραρνητικότητας σημαίνει ότι ένα άτομο έλκει εύκολα ηλεκτρόνια για να σχηματίσει έναν χημικό δεσμό με ένα άλλο άτομο. Μια χαμηλή τιμή ηλεκτραρνητικότητας σημαίνει ότι ένα άτομο δίνει εύκολα ηλεκτρόνια για να σχηματίσει έναν δεσμό ή είναι ηλεκτροθετικό .
Ενώ υπάρχουν διαγράμματα τιμών ηλεκτραρνητικότητας για στοιχεία του περιοδικού πίνακα, δεν υπάρχει πραγματική μοναδική τιμή ηλεκτραρνητικότητας για ένα άτομο. Αντίθετα, εξαρτάται από τα άλλα άτομα σε ένα μόριο και επίσης εξαρτάται από το πυρηνικό φορτίο και τον αριθμό των ηλεκτρονίων. Η πιο κοινή μέθοδος υπολογισμού της ηλεκτραρνητικότητας είναι η κλίμακα Pauling, η οποία προτάθηκε από τον Linus Pauling. Η κλίμακα Pauling κυμαίνεται από 0,79 έως 3,98. Η κλίμακα Pauling είναι αδιάστατη, αλλά μερικές φορές οι τιμές αναφέρονται στις Μονάδες Pauling .
Τα πιο ηλεκτροαρνητικά και τα πιο ηλεκτροθετικά στοιχεία
Το πιο ηλεκτραρνητικό στοιχείο είναι το φθόριο, με τιμή ηλεκτραρνητικότητας 3,98 στην κλίμακα Pauling. Το λιγότερο ηλεκτραρνητικό ή πιο ηλεκτροθετικό στοιχείο είναι το καίσιο, το οποίο έχει τιμή 0,79. Ωστόσο, το φράγκιο είναι πιθανώς ακόμη πιο ηλεκτροθετικό από το καίσιο επειδή έχει υψηλότερη ενέργεια ιονισμού. Η τιμή ηλεκτραρνητικότητας του Φραγκίου εκτιμάται ότι είναι περίπου 0,79, αλλά δεν έχει μετρηθεί εμπειρικά.
Ηλεκτραρνητικότητα και χημικός δεσμός
Η σύγκριση των τιμών ηλεκτραρνητικότητας επιτρέπει την πρόβλεψη του τύπου του χημικού δεσμού που θα σχηματιστούν δύο άτομα. Άτομα με τις ίδιες τιμές ηλεκτραρνητικότητας (π.χ., H2 , N2 ) σχηματίζουν ομοιοπολικούς δεσμούς. Άτομα με ελαφρώς διαφορετικές τιμές ηλεκτραρνητικότητας (π.χ. CO, H2 Ο) σχηματίζουν πολικούς ομοιοπολικούς δεσμούς. Όλα τα υδραλογονίδια (π.χ. HCl, HF) σχηματίζουν πολικούς ομοιοπολικούς δεσμούς. Άτομα με πολύ διαφορετικές τιμές ηλεκτραρνητικότητας (π.χ. NaCl) σχηματίζουν ιοντικούς δεσμούς. Σημειώστε ότι η ηλεκτραρνητικότητα δεν βοηθά στην πρόβλεψη εάν θα σχηματιστεί πραγματικά ένας χημικός δεσμός. Το αργό έχει υψηλή τιμή ηλεκτραρνητικότητας, ωστόσο είναι ένα ευγενές αέριο που σχηματίζει λίγους χημικούς δεσμούς.
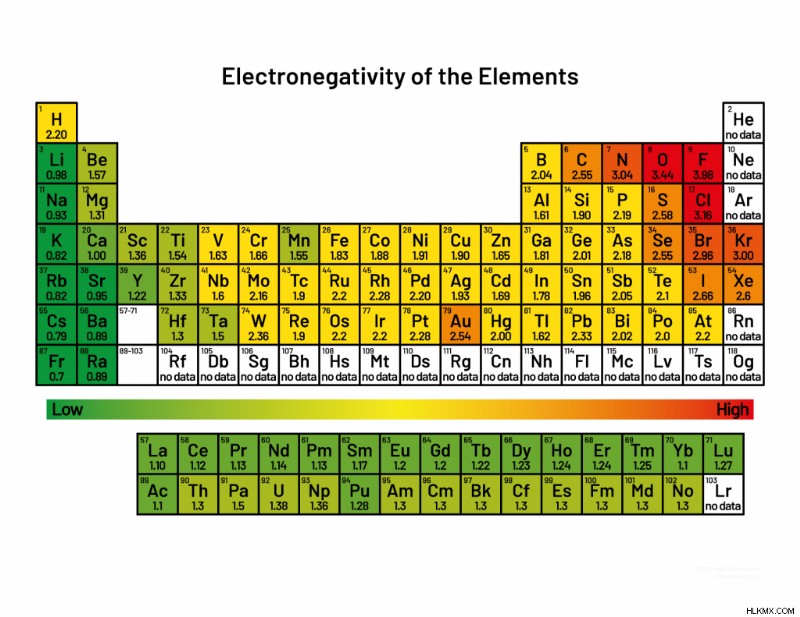
Τάση περιοδικού πίνακα ηλεκτροαρνητικότητας
Η ηλεκτροαρνητικότητα ακολουθεί μια τάση (περιοδικότητα) στον περιοδικό πίνακα. Η τάση φαίνεται στο γραφικό (το οποίο είναι διαθέσιμο και ως PDF για εκτύπωση).
- Η ηλεκτροαρνητικότητα αυξάνεται κινούμενος από αριστερά προς τα δεξιά κατά τη διάρκεια μιας περιόδου, από τα αλκαλικά μέταλλα έως τα αλογόνα. Τα ευγενή αέρια αποτελούν εξαίρεση στην τάση.
- Η ηλεκτροαρνητικότητα μειώνεται κινούμενος προς τα κάτω σε μια ομάδα περιοδικού πίνακα. Αυτό συμβαίνει επειδή η απόσταση μεταξύ του πυρήνα και των ηλεκτρονίων σθένους αυξάνεται.
- Η ηλεκτροαρνητικότητα ακολουθεί την ίδια γενική τάση με την ενέργεια ιονισμού. Τα στοιχεία με χαμηλές ηλεκτραρνητικότητες τείνουν να έχουν χαμηλές ενέργειες ιονισμού. Ομοίως, ένα άτομο με υψηλή ηλεκτραρνητικότητα τείνει να έχει υψηλή ενέργεια ιονισμού.
Αναφορές
- Jensen, William B. (1 Ιανουαρίου 1996). «Ηλεκτραρνητικότητα από το Avogadro στον Pauling:Μέρος 1:Προέλευση της έννοιας της ηλεκτροαρνητικότητας». J. Chem. Εκπαιδεύω . 73, 1. 11, Εκδόσεις ACS.
- Mullay, J. (1987). Εκτίμηση ατομικών και ομαδικών ηλεκτραρνητικοτήτων. Δομή και σύνδεση . 66. σελ. 1–25. doi:10.1007/BFb0029834. ISBN 978-3-540-17740-1.
- Pauling, Linus (1 Σεπτεμβρίου 1932). «Η φύση του χημικού δεσμού. IV. Η ενέργεια των απλών δεσμών και η σχετική ηλεκτροαρνητικότητα των ατόμων.» J. Am. Chem. Soc . 54, 9, 3570-3582. Εκδόσεις ACS.
- Pauling, Linus (31 Ιανουαρίου 1960). The Nature of the Chemical Bond and the Structure of Molecules and Crystals:An Introduction to Mode (3η έκδ.). Cornell University Press.




