Γεγονότα για το στοιχείο του γαλλίου

Το γάλλιο είναι ένα χημικό στοιχείο με ατομικό αριθμό 31 και σύμβολο στοιχείου Ga. Θεωρείται ότι είναι μέταλλο μετά τη μετάβαση ή βασικό μέταλλο. Το γάλλιο είναι γνωστό για το χαμηλό σημείο τήξης του, το οποίο προσφέρεται για την επίδειξη κουταλιού γαλλίου και ακόμη και για την τήξη του καθαρού μετάλλου στο χέρι σας. Ακολουθεί μια συλλογή γεγονότων για το γάλλιο, συμπεριλαμβανομένων της ανακάλυψης, των ιδιοτήτων, των χρήσεων και των πηγών του στοιχείου.
Βασικά στοιχεία για το Γάλλιο
Όνομα στοιχείου :Γάλλιο
Ατομικός αριθμός :31
Σύμβολο στοιχείου :Ga
Ατομική μάζα :69.723(1)
Ομάδα :Ομάδα 13 ή ομάδα βορίου
Περίοδος :Περίοδος 4
Αποκλεισμός :p-block
Οικογένεια στοιχείων :Μεταβατικό μέταλλο ή βασικό μέταλλο
Εμφάνιση :Σε θερμοκρασία δωματίου, το γάλλιο είναι ένα μαλακό, ασημί-μπλε στερεό μέταλλο.
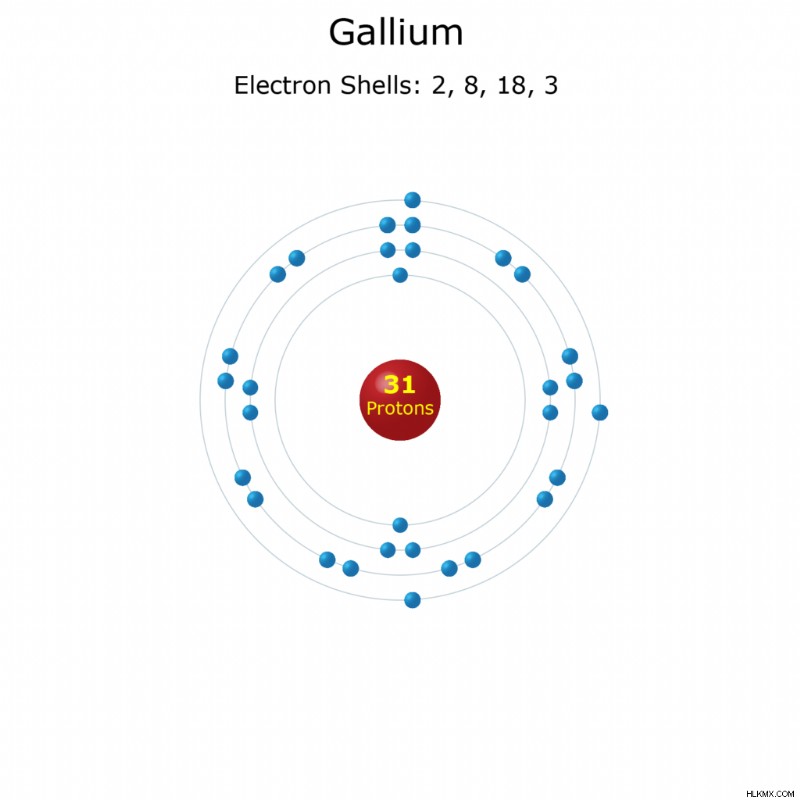
Διαμόρφωση ηλεκτρονίων :[Ar] 3d 4s 4p
Ανακάλυψη :Ο Lecoq de Boisbaudran ανακάλυψε και απομόνωσε το γάλλιο το 1875. Ωστόσο, ο Dmitri Mendeleev προέβλεψε την ύπαρξη του στοιχείου το 1871. Ο Mendeleev ονόμασε το προτεινόμενο στοιχείο "eka-aluminium" από τη θέση του στον περιοδικό πίνακα. Ο Lecoq de Boisbaudran αναγνώρισε το γάλλιο από δύο ιώδεις φασματικές γραμμές σε ένα δείγμα φαληρίτη. Απομόνωσε το στοιχείο χρησιμοποιώντας ηλεκτρόλυση του υδροξειδίου.
Προέλευση λέξης :Ο de Boisbaudran ονόμασε το στοιχείο 31 «gallia» για να τιμήσει την πατρίδα του, τη Γαλλία. Gallia είναι το λατινικό όνομα της Γαλατίας. Μερικοί λένε επίσης ότι το όνομα του de Boisbaudran ήταν λογοπαίγνιο, ονομάζοντας το στοιχείο τόσο για τον ίδιο όσο και για τη Γαλλία. Το «Le coq» είναι η γαλλική λέξη για τον «κόκορα», ενώ η λατινική λέξη για τον «κόκορα» είναι «gallus». Το στοιχείο αργότερα ονομάστηκε γάλλιο σε συμφωνία με το επίθημα -ium για μεταλλικά στοιχεία.
Ισότοπα :Τα 31 γνωστά ισότοπα γαλλίου κυμαίνονται από τον αριθμό μάζας 56 έως το 86. Δύο ισότοπα είναι σταθερά και απαντώνται στη φύση:το γάλλιο-69 και το γάλλιο-71. Το γάλλιο-69 αντιπροσωπεύει το 60,1% της φυσικής αφθονίας, ενώ το γάλλιο-71 το 39,9%. Όλα τα άλλα ισότοπα είναι ραδιενεργά.
Χρήσεις :Το γάλλιο χρησιμοποιείται για την κατασκευή θερμομέτρων, αντικαθιστώντας ιδιαίτερα τον τοξικό υδράργυρο. Το γάλλιο είναι σημαντικό για την παραγωγή συσκευών στερεάς κατάστασης και ημιαγωγών νάρκωσης. Το αρσενίδιο του γαλλίου μετατρέπει την ηλεκτρική ενέργεια σε συνεκτικό φως. Το μέταλλο σχηματίζει μια λαμπρή επίστρωση καθρέφτη. Η καρδιά που χτυπά με γάλλιο είναι μια ασφαλέστερη εναλλακτική λύση στην επίδειξη καρδιάς που χτυπά υδράργυρο.
Βιολογικός ρόλος :Το γάλλιο δεν παίζει κανέναν ρόλο στη βιολογία του ανθρώπου, των ζώων ή των φυτών. Το καθαρό μέταλλο θεωρείται μη τοξικό. Ωστόσο, το γάλλιο αντικαθιστά τον σίδηρο (III) στο σώμα. Σε βακτήρια, όπως το Ψευδομονάδα , η πρόσληψη γαλλίου μπορεί να επηρεάσει την αναπνοή και να οδηγήσει σε κυτταρικό θάνατο. Στην ιατρική του ανθρώπου, το γάλλιο χρησιμοποιείται για την παρακολούθηση της φλεγμονής και την επισήμανση όγκων. Το στοιχείο έχει αντικαρκινικές ιδιότητες, ιδιαίτερα κατά του λεμφώματος μη Hodgkin και του καρκίνου του ουροθηλίου. Μια ένωση γαλλίου αμίνης-φαινόλης είναι τοξική για τα παράσιτα της ελονοσίας, συμπεριλαμβανομένων εκείνων που είναι ανθεκτικά στη χλωροκίνη.
Πηγές :Η κύρια εμπορική πηγή γαλλίου είναι το μετάλλευμα βωξίτη. Η παραγωγή γαλλίου είναι υποπροϊόν της επεξεργασίας αλουμινίου. Μικρότερες ποσότητες γαλλίου εξάγονται από φαληρίτη, άλλα μεταλλεύματα θειούχου ψευδαργύρου και ορισμένους τύπους άνθρακα. Η απομόνωση του γαλλίου πραγματοποιείται με ηλεκτρόλυση του υδροξειδίου του σε διάλυμα υδροξειδίου του καλίου.
Φυσικά δεδομένα
Πυκνότητα :5,91 g/cm
Σημείο τήξης :302,9146 K (29,7646 °C, 85,5763 °F)
Σημείο βρασμού :2673 K (2400 °C, 4352 °F)
Κατάσταση στους 20ºC: Στερεά
Heat of Fusion :5,59 kJ/mol
Θερμότητα εξάτμισης :256 kJ/mol
Μοριακή θερμική ικανότητα :25,86 J/(mol·K)
Μαγνητική σειρά :Διαμαγνητικό
Κρυσταλλική Δομή :Ορθορομβικό
Σκληρότητα Mohs :1,5
Ατομικά δεδομένα
Ατομική ακτίνα :135 μ.μ. (εμπειρικό)
Ομοιοπολική ακτίνα :122±3 μ.μ.
Ακτίνα Van der Waals :187 μ.μ.
Ηλεκτραρνητικότητα :1,81 (Κλίμακα Pauling)
1η Ενέργεια Ιονισμού :578,8 kJ/mol
2η Ενέργεια Ιονισμού :1979,3 kJ/mol
3η Ενέργεια Ιονισμού :2963 kJ/mol
Κατάσταση οξείδωσης :-5, -4, -2, -1, +1, +2, +3
10 Γεγονότα για το Γάλλιο

- Το στοιχειακό γάλλιο δεν υπάρχει ελεύθερο στη φύση. Ωστόσο, η τήξη απελευθερώνει εύκολα το μέταλλο.
- Μπορείτε να λιώσετε το γάλλιο στην παλάμη του χεριού σας ή να φτιάξετε ένα κουτάλι από αυτό που θα λιώσει σε ένα ζεστό ρόφημα.
- Από όλα τα στοιχεία, το γάλλιο έχει το υψηλότερο εύρος θερμοκρασίας ως υγρό. Υπάρχουν 2373 °C μεταξύ του σημείου τήξης του γαλλίου και του σημείου βρασμού!
- Σε αντίθεση με τις περισσότερες ουσίες, το γάλλιο διαστέλλεται όταν παγώνει. Ένα άλλο υλικό που εμφανίζει αυτή τη συμπεριφορά είναι το νερό. Το γάλλιο δεν πρέπει να φυλάσσεται σε γυάλινα ή μεταλλικά δοχεία γιατί μπορεί να σπάσουν όταν στερεοποιηθεί το στοιχείο.
- Το αρσενίδιο του γαλλίου χρησιμοποιείται για την παραγωγή εξαιρετικά φωτεινών μπλε LED.
- Το υγρό γάλλιο σχηματίζει έναν εξαιρετικό καθρέφτη επειδή το στοιχείο βρέχει πολλές επιφάνειες. Το γάλλιο βρέχει το γυαλί, την πορσελάνη, ακόμη και το ανθρώπινο δέρμα.
- Η "καρδιά που χτυπά το γάλλιο" είναι ένα ασφαλές υποκατάστατο για την επίδειξη χημείας "καρδιά που χτυπά υδράργυρο".
- Πάνω από το 95% του γαλλίου χρησιμοποιείται στη βιομηχανία ημιαγωγών.
- Το καθαρό γάλλιο αντιστέκεται στην επίθεση από ανόργανα οξέα. Το στρώμα οξειδίου που σχηματίζεται στην επιφάνεια προστατεύει το εσωτερικό.
- Όταν προστίθεται σε άλλα μέταλλα, το γάλλιο σχηματίζει κράματα χαμηλής τήξης.
Αναφορές
- Greenwood, N. N.; Earnshaw, Α. (1997). Χημεία των Στοιχείων (2η έκδ.). Οξφόρδη:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- Lehto, R. S. (1968). "Ψευδάργυρος". Στο Clifford A. Hampel. Η Εγκυκλοπαίδεια των Χημικών Στοιχείων . Νέα Υόρκη:Reinhold Book Corporation. σελ. 822–830. ISBN 0-442-15598-0.
- Lide, David R., ed. (2006) Εγχειρίδιο Χημείας και Φυσικής (87η έκδ.). Boca Raton, Φλόριντα:CRC Press, Taylor &Francis Group. ISBN 0-8493-0487-3.
- Nordberg, Gunnar F.; Fowler, Bruce A.; Nordberg, Monica (2014). Εγχειρίδιο για την Τοξικολογία των Μετάλλων (4η έκδ.). Ακαδημαϊκός Τύπος. σελ. 788–90. ISBN 978-0-12-397339-9.




