Διαφορά μεταξύ ισχυρών και αδύναμων ηλεκτρολυτών
Κύρια διαφορά – Ισχυροί έναντι αδύναμων ηλεκτρολυτών
Οι ηλεκτρολύτες είναι ουσίες που δίνουν ιόντα όταν διαλύονται στο νερό. Οι τρεις κύριοι τύποι ηλεκτρολυτών είναι τα οξέα, οι βάσεις και τα άλατα και αυτές οι ενώσεις διασπώνται σε ιόντα όταν διαλύονται στο νερό. Τα θετικά φορτισμένα και αρνητικά φορτισμένα ιόντα μπορούν να μεταφέρουν ηλεκτρισμό μέσω ενός υδατικού διαλύματος αυτών των ενώσεων. Μερικοί ηλεκτρολύτες είναι ισχυρές ενώσεις και άλλοι είναι ασθενείς ηλεκτρολύτες. Η κύρια διαφορά μεταξύ ισχυρών ηλεκτρολυτών και αδύναμων ηλεκτρολυτών είναι ότι ισχυροί ηλεκτρολύτες μπορούν σχεδόν πλήρως να διασπαστούν στα ιόντα τους, ενώ οι ασθενείς ηλεκτρολύτες μερικώς διαχωρίζονται σε ιόντα.
Βασικές περιοχές που καλύπτονται
1. Τι είναι οι ισχυροί ηλεκτρολύτες
– Ορισμός, Ιδιότητες, Αντιδράσεις
2. Τι είναι οι Αδύναμοι ηλεκτρολύτες
– Ορισμός, Ιδιότητες, Αντιδράσεις
3. Ποια είναι η διαφορά μεταξύ ισχυρών και αδύναμων ηλεκτρολυτών
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Οξέα, βάσεις, ηλεκτρολύτες, άλατα, ισχυροί ηλεκτρολύτες, αδύναμοι ηλεκτρολύτες 
Τι είναι οι ισχυροί ηλεκτρολύτες
Ένας ισχυρός ηλεκτρολύτης είναι μια ένωση που μπορεί να διασπαστεί πλήρως στα ιόντα της όταν διαλυθεί στο νερό. Επομένως, ένας ισχυρός ηλεκτρολύτης είναι μια διαλυμένη ουσία που διαλύεται πλήρως στο νερό. Ένας ηλεκτρολύτης αποτελείται από κατιόντα ή θετικά φορτισμένα ιόντα και ανιόντα ή αρνητικά φορτισμένα ιόντα. Αυτά τα ιόντα μπορούν να μεταφέρουν ηλεκτρικό ρεύμα σε ένα διάλυμα.
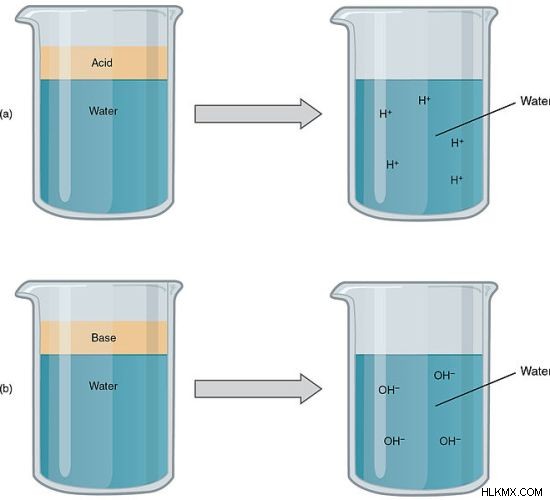
Εικόνα 1:Τα ισχυρά οξέα και οι ισχυρές βάσεις είναι ισχυροί ηλεκτρολύτες
Κοινοί ισχυροί ηλεκτρολύτες είναι τα ισχυρά οξέα, οι ισχυρές βάσεις και τα ιοντικά άλατα. Ωστόσο, ορισμένοι ηλεκτρολύτες δεν διαλύονται πλήρως στο νερό αλλά θεωρούνται ισχυροί ηλεκτρολύτες. Αυτό συμβαίνει επειδή η ποσότητα που διαλύεται ιονίζεται πλήρως στα ιόντα της.
Για παράδειγμα, ισχυρά οξέα όπως HCl, HNO3 είναι ισχυροί ηλεκτρολύτες. Αυτά διασπώνται στο κατιόν τους Η και το ανιόν πλήρως. Ισχυρές βάσεις όπως το NaOH διασπώνται πλήρως σε ιόντα που μπορούν να μεταφέρουν ηλεκτρισμό.
Τι είναι οι Αδύναμοι ηλεκτρολύτες
Οι αδύναμοι ηλεκτρολύτες είναι ενώσεις που διασπώνται εν μέρει στα ιόντα τους όταν διαλύονται στο νερό. Οι αδύναμοι ηλεκτρολύτες αποτελούνται από κατιόντα και ανιόντα. Ο ιοντικός χαρακτήρας αυτών των ενώσεων είναι μικρότερος σε σύγκριση με ισχυρούς ηλεκτρολύτες. Κοινοί ασθενείς ηλεκτρολύτες είναι τα ασθενή οξέα, οι ασθενείς βάσεις και τα άλατα.
Συνήθως, περίπου το 1-10% της ένωσης διασπάται σε ιόντα. Οι περισσότερες ενώσεις που περιέχουν άζωτο είναι ασθενείς ηλεκτρολύτες. Το νερό θεωρείται επίσης ως αδύναμος ηλεκτρολύτης, καθώς τα μόρια του νερού διασπώνται μερικώς σε ιόντα Η και ΟΗ.
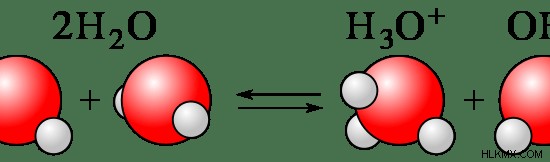
Εικόνα 2:Τα μόρια του νερού διασπώνται μερικώς σε ιόν
Δεδομένου ότι αυτοί οι ασθενείς ηλεκτρολύτες διαλύονται μερικώς στο νερό, ένα διάλυμα αδύναμων ηλεκτρολυτών αποτελείται από μόρια, κατιόντα και ανιόντα. Δεδομένου ότι υπάρχουν πολλά ηλεκτρικά φορτισμένα ιόντα, αυτά τα διαλύματα μπορούν να μεταφέρουν ηλεκτρικό ρεύμα.
Μερικοί συνηθισμένοι ασθενείς ηλεκτρολύτες είναι αδύναμα οξέα όπως το H2 CO3 , και αδύναμες βάσεις όπως NH3 . Για ασθενείς ηλεκτρολύτες, οι σταθερές διάστασης είναι σημαντικές για την πρόβλεψη της ικανότητας του ηλεκτρικού φορτίου που μπορεί να μεταφερθεί μέσω ενός διαλύματος, καθώς η διάσταση της ένωσης σχηματίζει τα διαλυτά ιόντα που μπορούν να μεταφέρουν ηλεκτρισμό.
Διαφορά μεταξύ ισχυρών και αδύναμων ηλεκτρολυτών
Ορισμός
Ισχυροί ηλεκτρολύτες: Οι ισχυροί ηλεκτρολύτες είναι ενώσεις που μπορούν να διασπαστούν πλήρως στα ιόντα τους όταν διαλυθούν στο νερό.
Αδύναμοι ηλεκτρολύτες: Οι αδύναμοι ηλεκτρολύτες είναι ενώσεις που διασπώνται εν μέρει στα ιόντα τους όταν διαλύονται στο νερό.
Διάσπαση
Ισχυροί ηλεκτρολύτες: Οι ισχυροί ηλεκτρολύτες μπορούν να διασπαστούν πλήρως σε ιόντα.
Ασθενείς ηλεκτρολύτες: Οι ασθενείς ηλεκτρολύτες διασπώνται μερικώς σε ιόντα.
Παραδείγματα
Ισχυροί ηλεκτρολύτες: Ισχυροί ηλεκτρολύτες είναι ισχυρά οξέα, ισχυρές βάσεις και ορισμένα άλατα.
Ασθενείς ηλεκτρολύτες: Ασθενείς ηλεκτρολύτες είναι αδύναμα οξέα, ασθενείς βάσεις και ορισμένα άλατα.
Συμπέρασμα
Οι ηλεκτρολύτες είναι ενώσεις που μπορούν να διαλυθούν στο νερό για να απελευθερώσουν κατιόντα και ανιόντα. Αυτά τα ιόντα μπορούν να συμβάλουν στην αγωγή του ηλεκτρισμού μέσω ενός διαλύματος. Η κύρια διαφορά μεταξύ ισχυρών ηλεκτρολυτών και αδύναμων ηλεκτρολυτών είναι ότι οι ισχυροί ηλεκτρολύτες μπορούν σχεδόν πλήρως να διασπαστούν στα ιόντα τους, ενώ οι ασθενείς ηλεκτρολύτες μερικώς διασπαστούν σε ιόντα.




