Πώς να βρείτε τη μοριακή μάζα
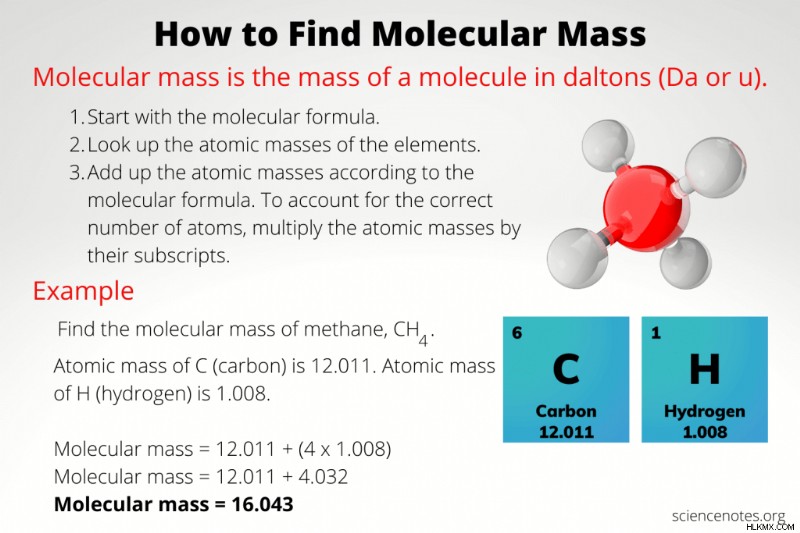
Μοριακή μάζα είναι η μάζα ενός μορίου. Συνήθως, αναφέρετε τη μοριακή μάζα (m) σε μονάδες daltons (Da) ή μονάδες ατομικής μάζας (amu ή u). Δείτε πώς μπορείτε να βρείτε τη μοριακή μάζα, παραδείγματα υπολογισμών και μια ματιά στη διαφορά μεταξύ μοριακής μάζας και μοριακής μάζας.
- Γράψτε τον μοριακό τύπο για το μόριο ή την ένωση.
- Αναζητήστε τις ατομικές μάζες κάθε στοιχείου στον τύπο.
- Πολλαπλασιάστε κάθε ατομική μάζα με τον δείκτη της στον τύπο.
- Προσθέστε τις ατομικές μάζες κάθε στοιχείου.
Πώς να βρείτε τη μοριακή μάζα
Ο υπολογισμός της μοριακής μάζας απαιτεί να γνωρίζετε τον αριθμό και τον τύπο των ατόμων που απαρτίζουν το μόριο. Μόλις μάθετε την ατομική σύνθεση του μορίου, χρησιμοποιείτε τον περιοδικό πίνακα για να βρείτε τη μάζα κάθε ατόμου και να τα προσθέσετε μαζί. Ο αριθμός των ατόμων κάθε στοιχείου είναι ο δείκτης του στον μοριακό τύπο. Εάν δεν υπάρχει δείκτης μετά από ένα σύμβολο στοιχείου, σημαίνει ότι υπάρχει ένα άτομο αυτού του στοιχείου στον τύπο.
Για παράδειγμα, το νερό έχει τον μοριακό τύπο H2 Ο. Αυτό σημαίνει ότι ένα μόριο νερού περιέχει δύο άτομα υδρογόνου και ένα άτομο οξυγόνου.
Ο περιοδικός πίνακας δείχνει ότι η ατομική μάζα του υδρογόνου είναι 1,0008 amu και η ατομική μάζα του οξυγόνου είναι 15,999 amu. Η μοριακή μάζα του νερού θα είναι 2 μάζες υδρογόνου συν τη μάζα του οξυγόνου.
μοριακή μάζα H2 O =(2 x 1,008 amu) + (15,999 amu)
μοριακή μάζα H2 O =2,016 amu + 15,999 amu
μοριακή μάζα H2 O =18,015 amu
Η μοριακή μάζα του νερού είναι 18,015 amu.
Θυμηθείτε ότι ένα amu ισοδυναμεί με 1 γραμμάριο/γραμμομόριο. Έτσι μπορείτε να βρείτε το μοριακό βάρος ενός μορίου. Αυτό σημαίνει ότι ένα mole νερού ζυγίζει 18,015 γραμμάρια.
Υπολογισμός παραδείγματος μοριακής μάζας
Παράδειγμα:
Ποια είναι η μοριακή μάζα του θειικού οξέος (H2 SO4 )?
Λύση :
Κάθε μόριο θειικού οξέος περιέχει 2 άτομα υδρογόνου, 1 άτομο θείου και 4 άτομα οξυγόνου. Άρα η μοριακή μάζα είναι:
Μοριακή μάζα H2 SO4 =(2 x μάζα υδρογόνου) + (1 x μάζα θείου) + (4 x μάζα οξυγόνου)
Από τον περιοδικό πίνακα, βλέπουμε
μάζα Η =1,008 amu
μάζα S =32,066 amu
μάζα Ο =15.999 amu
Συνδέστε αυτές τις τιμές στον τύπο.
Μοριακή μάζα H2 SO4 =(2 x 1,008 amu) + (1 x 32,066 amu) + (4 x 15,999 amu)
Μοριακή μάζα H2 SO4 =2,016 amu + 32,066 amu + 63,996 amu
Μοριακή μάζα H2 SO4 =98.078 amu
Απάντηση:
Η μοριακή μάζα του θειικού οξέος είναι ίση με 98,078 amu ή 98,078 γραμμάρια/mole.
Διαφορά μεταξύ μοριακής μάζας και μοριακής μάζας
Η μοριακή μάζα μιας ένωσης είναι η μάζα του δείγματος διαιρούμενη με τον αριθμό των mol. Έτσι, ενώ αναφέρετε τη μοριακή μάζα σε daltons ή amu, η μοριακή μάζα είναι σε κιλά ανά mole (kg/mol) ή γραμμάρια ανά mole (g/mol). Τεχνικά, ο συνηθισμένος υπολογισμός μοριακής μάζας είναι πραγματικά ένας υπολογισμός μοριακής μάζας. Αυτό συμβαίνει επειδή ο υπολογισμός χρησιμοποιεί τις μέσες ατομικές μάζες από τον περιοδικό πίνακα, οι οποίες είναι σταθμισμένοι μέσοι όροι μάζας με βάση την αφθονία των ισοτόπων των φυσικών στοιχείων.
Τις περισσότερες φορές, η μοριακή μάζα και η μοριακή μάζα είναι εναλλάξιμα. Ωστόσο, υπάρχουν δύο εξαιρέσεις.
- Μπορεί να μην χρησιμοποιήσετε τις σχετικές τιμές ατομικής μάζας από τον περιοδικό πίνακα. Για παράδειγμα, θεωρήστε τη μοριακή μάζα του D2 O, όπου D σημαίνει το ισότοπο υδρογόνου δευτερίου. Εδώ, η ατομική μάζα του ισοτόπου είναι 2,014 (όχι 1,008, όπως χρησιμοποιείτε για το «υδρογόνο» γενικά). Η μοριακή μάζα είναι (2 x 2,014) + 15,999 =20,027 amu. Η ίδια κατάσταση ισχύει κάθε φορά που χρησιμοποιείτε δείγματα με γνωστές ισοτοπικές αναλογίες.
- Εάν θέλετε πραγματικά τη μάζα ενός μόνο μορίου, μπορείτε να ονομάσετε την τιμή "μοριακή μάζα". Εδώ, παίρνετε τη μοριακή μάζα και τη διαιρείτε με τον αριθμό του Avogadro. Για παράδειγμα, η μάζα ενός μόνο μορίου νερού είναι 18,015 g/mol ÷ 6,022 x 10 μόρια/mol. Άρα, η μάζα ενός μεμονωμένου μορίου νερού είναι περίπου 2,991×10 g.
Αναφορές
- International Bureau of Weights and Measures (2006). Το Διεθνές Σύστημα Μονάδων (SI) (8η έκδ.). ISBN 92-822-2213-6.
- International Union of Pure and Applied Chemistry (1993). Ποσότητες, μονάδες και σύμβολα στη Φυσικοχημεία (2η έκδ.). Oxford:Blackwell Science. ISBN 0-632-03583-8.
- Possolo, Antonio; van der Veen, Adriaan M. H.; Meija, Juris; Hibbert, D. Brynn (2018). «Ερμηνεία και διάδοση της αβεβαιότητας των τυπικών ατομικών βαρών (Τεχνική Έκθεση IUPAC)». Καθαρή και Εφαρμοσμένη Χημεία . 90 (2):395–424. doi:10.1515/pac-2016-0402
- Wieser, M. E. (2006). "Atomic Weights of the Elements 2005." Καθαρή και Εφαρμοσμένη Χημεία . 78 (11):2051–66. doi:10.1351/pac200678112051