Πυρηνόφιλες αντιδράσεις προσθήκης
Η Πυρηνόφιλη προσθήκη είναι μια αντίδραση προσθήκης στην οποία ένα πυρηνόφιλο αντιδρά με έναν ηλεκτροφιλικό καρβονυλ άνθρακα. Ως αποτέλεσμα, δημιουργείται ένας νέος δεσμός σίγμα. Αυτοί οι τύποι αντιδράσεων βοηθούν στην ανάπτυξη νέων πολύπλοκων οργανικών χημικών ουσιών. Το πιο σημαντικό, αυτή η αντίδραση κατέχει μια σημαντική θέση στην οργανική χημεία επειδή υλοποιεί την αναδιοργάνωση του καρβονυλίου σε διαφορετικά είδη λειτουργικών ομάδων. Οι διάφοροι τύποι πυρηνόφιλων και οι αλληλένδετες αντιδράσεις μας βοηθούν στη βιολογική σύνθεση ενώσεων στη μεταβολική διαδικασία των ζωντανών όντων.
Κανονικά, οι πυρηνόφιλες αντιδράσεις προσθήκης καρβονυλικών ενώσεων μπορούν να χωριστούν στα ακόλουθα τρία βήματα:
Ο ηλεκτροφιλικός καρβονυλ άνθρακας δημιουργεί έναν δεσμό σίγμα με το πυρηνόφιλο.
Ο δεσμός άνθρακα-οξυγόνου pi υποδιαιρείται, δημιουργώντας ένα αλκοξείδιο που παρεμβάλλεται.
Η επακόλουθη πρωτονίωση του αλκοξειδίου δημιουργεί τα παράγωγα αλκοόλης.
Η αντιδραστικότητα των καρβονυλικών ενώσεων
Αυτή η αντιδραστικότητα εξαρτάται κυρίως από την απεραντοσύνη του ενεργού φορτίου στο άτομο καρβονυλίου. Είναι επίσης γνωστό ότι η αντιδραστικότητα είναι υψηλότερη για τον άνθρακα με έλλειψη ηλεκτρονίων. Ομάδες αγκυρωμένες στον άνθρακα καρβονυλίου επηρεάζονται από την αντιδραστικότητα των Καρβονυλικών Ενώσεων προς την Πυρηνόφιλη Αντίδραση Προσθήκης.
Οι Αλδεΰδες είναι πιο αντιδραστικές στις πυρηνόφιλες αντιδράσεις προσθήκης σε σύγκριση με τις κετόνες. Ως εκ τούτου, το πρωτογενές καρβοκατιόν που σχηματίζεται από τις κετόνες είναι κυρίως πιο επιρρεπές σε πυρηνόφιλες προσβολές, ενώ το δευτερογενές καρβοκατιόν των κετονών σταθεροποιείται από γειτονικές ομάδες R.
Ο μηχανισμός της πυρηνόφιλης αντίδρασης προσθήκης:
Τα βήματα που εμπλέκονται στον μηχανισμό των αντιδράσεων πυρηνόφιλης προσθήκης είναι:
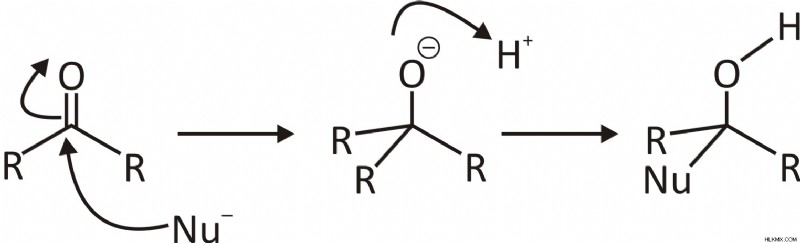
Το Πυρηνόφιλο δημιουργεί δεσμό με το ηλεκτρόφιλο άτομο άνθρακα C=O, που προκύπτει από τον επαναυβριδισμό του άνθρακα καρβονυλίου από sp2 σε sp3. Τα ηλεκτρόνια που υπάρχουν στον δεσμό pi έλκονται προς τα ηλεκτραρνητικά άτομα οξυγόνου, το οποίο, ως αποτέλεσμα, μας δίνει ένα ενδιάμεσο τετραεδρικό αλκοξείδιο.
Όταν προστίθεται ένα οξύ για την παραγωγή αλκοόλης, το αλκοξείδιο πρωτονιώνεται.
Τα πυρηνόφιλα που είναι ισχυρά, όπως το RMgX (αντιδραστήριο Grignard), το RLi και άλλα προστίθενται απευθείας στον δεσμό C=O. Ενώ τα πυρηνόφιλα που είναι αδύναμα όπως το H2O, το ROH και το RNH2, χρειάζονται όξινους καταλύτες.
Η πυρηνόφιλη αντίδραση προσθήκης παίζει κρίσιμο ρόλο στην οργανική χημεία. Είναι μια αντίδραση όπου μια χημική ένωση με ηλεκτρόφιλη αντίδραση αντιδρά με πυρηνόφιλο διπλά ή τριπλάσια. Αυτή η αντίδραση δίνει ένα συνολικό αποτέλεσμα υποκατάστασης.
Τύποι αντιδράσεων προσθήκης
Η πυρηνόφιλη προσθήκη νερού-
Είναι μια χημική αντίδραση κατά την οποία πραγματοποιείται πυρηνόφιλη προσθήκη νερού σε μια καρβονυλική ένωση, η οποία έχει ως αποτέλεσμα μια διόλη. Οι αντιδράσεις πυρηνόφιλης προσθήκης νερού είναι αργές υπό ουδέτερες συνθήκες.
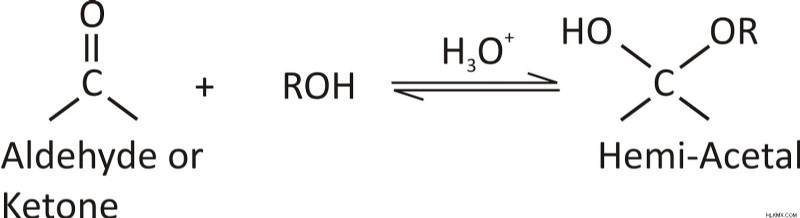
Η πυρηνόφιλη προσθήκη των αλκοολών:
Γενικά, αυτή η αντίδραση λαμβάνει χώρα παρουσία ενός όξινου καταλύτη. Για παράδειγμα, για να σχηματίσουν ημιακετάλη, οι αλδεΰδες και οι κετόνες περνούν από μια πυρηνόφιλη αντίδραση προσθήκης με αλκοόλες.
Οι αντιδράσεις με το υδροκυάνιο:
Σχηματισμός κυανοϋδρίνης
Πυρηνόφιλες αντιδράσεις προσθήκης μεταξύ υδροκυανίου (HCN) και ενώσεων καρβονυλίου (αλδεΰδες και κετόνες) σχηματίζουν κυανοϋδρίνες.
Το κυανίδιο (HC≡N) μπορεί επίσης να προστεθεί αναστρέψιμα στο νερό για να σχηματίσει προϊόντα που ονομάζονται κυανοϋδρίνες.
RCH=O + H–C≡N → RCH(OH)CN (μια κυανοϋδρίνη)
Λόγω του γεγονότος ότι το υδροκυάνιο είναι από μόνο του οξύ (pKa =9,25), η προσθήκη δεν μπορεί να καταλυθεί με οξύ. Κάθε φορά που χρησιμοποιείται το ανιόν κυανίου, C≡N-, πρέπει να προστίθεται μια καταλυτική βάση. Μια φιλική προς τις αλδεΰδες αντίδραση, κυκλικές κετόνες και μεθυλοκετόνες μπορεί να σχηματιστούν ανεμπόδιστα.
Επομένως, αυτή η αντίδραση δεν γίνεται γενικά με χρήση υδροκυανίου (HCN) μόνο επειδή το HCN είναι ένα επικίνδυνο, δηλητηριώδες αέριο. Επομένως, το διάλυμα κυανιούχου νατρίου ή καλίου αναμιγνύεται με αλδεΰδη ή κετόνη στο νερό, το οποίο αποτελείται από μια μικρή ποσότητα θειικού οξέος. Αυτό το διάλυμα περιέχει όχι μόνο HNC αλλά περιέχει επίσης κάποια ποσότητα ελεύθερων ιόντων κυανίου.
NH3 και τα παράγωγά της
Η NH3 αναφέρεται επίσης ως αμμωνία. Τα παράγωγά του είναι:
Η αντίδραση με Πρωτογενείς Αμίνες για να σχηματιστούν Ιμίνες:
Τα παράγωγα ιμίνης σχηματίζονται από αλδεΰδες και κετόνες με αμμωνία ή 1º-αμίνες, γνωστές και ως βάσεις Schiff. Έτσι, το νερό αποβάλλεται στην αντίδραση, το οποίο καταλύεται ακριβώς από οξύ και είναι αναστρέψιμο, παρόμοια με το σχηματισμό ακετάλης. Επομένως, το pH για τέτοιες αντιδράσεις, που σχηματίζουν ενώσεις ιμίνης, θα πρέπει να λαμβάνεται μέριμνα και να ελέγχεται. Σε χαμηλό pH, κυρίως όλες οι αμίνες συνδέονται καθώς το αμμώνιο του ενώνεται με οξύ, καθιστώντας το μη πυρηνόφιλο. Ενώ, σε υψηλό επίπεδο pH, δεν υπάρχει αρκετό οξύ για να πρωτονιωθεί στο ενδιάμεσο ώστε να επιτραπεί η απομάκρυνση του νερού.
Αναστρεψιμότητα των αντιδράσεων σχηματισμού ιμίνης:
Υπό όξινες συνθήκες, οι ιμίνες μπορούν να υδρολυθούν πίσω στην αντίστοιχη πρωτοταγή αμίνη.
Αντιδράσεις που περιλαμβάνουν άλλα αντιδραστήρια του τύπου Y-NH2:
Μερικές φορές, η απομόνωση και ο καθαρισμός των Imines μπορεί να είναι προβληματική λόγω της ευαισθησίας τους στην υδρόλυση. Αντίστοιχα, άλλα Αντιδραστήρια του Y-NH2 έχουν μελετηθεί διεξοδικά και βρέθηκε ότι δίνουν σταθερά και θετικά προϊόντα, κάτι που είναι χρήσιμο στον χαρακτηρισμό των αλδεϋδών και των κετονών από τις οποίες ακριβώς έχει κατασκευαστεί.
Αντίδραση με δευτεροταγείς αμίνες για σχηματισμό εναμινών
Πολλές αλδεΰδες και κετόνες αντιδρούν με 2º αμίνες για να παραδώσουν προϊόντα που αναφέρονται ως εναμίνες. Σε αυτό, η αντίδραση με το νερό χάνεται επειδή αυτά καταλύονται με οξύ. Αντίστοιχα, οι Εναμίνες μπορούν εύκολα να μετατραπούν ξανά σε καρβονυλικό εκκινητή μέσω υδρόλυσης που καταλύεται από οξύ.




