Γεγονότα πυριτίου
Το πυρίτιο είναι το 14 στοιχείο του περιοδικού πίνακα. Αυτά τα στοιχεία πυριτίου περιέχουν χημικά και φυσικά δεδομένα μαζί με γενικές πληροφορίες και ιστορικό.

Κυψέλη περιοδικού πίνακα πυριτίου
Βασικά στοιχεία για το πυρίτιο
Όνομα: Πυρίτιο
Ατομικός αριθμός: 14
Σύμβολο στοιχείου: Si
Ομάδα: 14
Περίοδος: 3
Αποκλεισμός: p
Οικογένεια στοιχείων: Μεταλλοειδής ή Ημιμεταλλική
Ατομική μάζα: [28.084; 28.086]
Κατευθυντήριες γραμμές της IUPAC που αντικατοπτρίζουν το φυσικό και χημικό ιστορικό του δείγματος μαγνησίου. Εάν απαιτείται μία μόνο τιμή της ατομικής μάζας, χρησιμοποιήστε 28.0855.
Διαμόρφωση ηλεκτρονίου: [Ne]3s3p (συντομογραφία) ή 1s2s2p3s3p(πλήρη)
Ανακάλυψη: Jöns Jacob Berzelius το 1824.
Οι ενώσεις πυριτίου ήταν συνηθισμένες από την αρχαιότητα. Ο πυριτόλιθος είναι ένα ορυκτό οξειδίου του πυριτίου και ήταν η βάση για πολλά προϊστορικά εργαλεία. Η άμμος, μια άλλη ένωση πυριτίου, έγινε γυαλί. Ο Γάλλος χημικός Antoine Lavoisier ήταν ο πρώτος που έγραψε για την πιθανότητα το πυρίτιο να περιέχει ένα άγνωστο στοιχείο. Αρκετοί χημικοί προσπάθησαν να απομονώσουν πυρίτιο χρησιμοποιώντας ηλεκτρόλυση, αλλά δεν τα κατάφεραν. Ο Jöns Jacob Berzelius κατάφερε να απομονώσει πυρίτιο χρησιμοποιώντας χημικές διεργασίες το 1824.
Προέλευση ονόματος: Ο Sir Humphry Davy πρότεινε το όνομα slicium το 1808 για μετά τη λατινική λέξη silex που σημαίνει πυριτόλιθος. Πίστευε ότι το πυρίτιο ήταν μέταλλο και πρόσθεσε το επίθημα -ium. Το 1817, ο Σκωτσέζος χημικός Thomas Thomson ανακάλυψε ότι το πυρίτιο δεν ήταν μέταλλο, αλλά περισσότερο σαν βόριο. Άλλαξε το όνομα του Davy ανταλλάσσοντας το επίθημα σε -on.
Ισότοπα:
Το φυσικό πυρίτιο αποτελείται από τρία σταθερά ισότοπα:Si, Si και Si. Ποσότητες ιχνών Si εξέρχονται όταν οι κοσμικές ακτίνες αντιδρούν με το ατμοσφαιρικό αργό. Είκοσι ραδιενεργά ισότοπα έχουν παραχθεί κάτω από εργαστηριακές συνθήκες που κυμαίνονται από Si έως Si.
Το Si
Το πυρίτιο-28 είναι ένα σταθερό ισότοπο που περιέχει 14 νετρόνια. Το 92,223% του φυσικού πυριτίου είναι πυρίτιο-28.
Το Si
Το πυρίτιο-29 είναι ένα σταθερό ισότοπο που περιέχει 15 νετρόνια. Το 4,685% του φυσικού πυριτίου είναι πυρίτιο-29.
Το Si
Το πυρίτιο-30 είναι ένα σταθερό ισότοπο που περιέχει 16 νετρόνια. Το 3,092% του φυσικού πυριτίου είναι πυρίτιο-30.
Το Si
Το πυρίτιο-32 είναι ένα ραδιενεργό ισότοπο που περιέχει 18 νετρόνια. Το πυρίτιο-32 σχηματίζεται ως θυγατρικό σωματίδιο από την αντίδραση μεταξύ κοσμικής ακτινοβολίας και ατμοσφαιρικού αργού. Διασπάται περαιτέρω με β- διάσπαση σε P με χρόνο ημιζωής 15.319 χρόνια.

Πυρίτιο (Enricoros/Creative Commons)
Φυσικά δεδομένα
Πυκνότητα: 2,3296 g/cm
Σημείο τήξης: 1687 K(1414 °C, 2577 °F)
Σημείο βρασμού: 3538 K(3265 °C, 5909 °F)
Κατάσταση στους 20ºC: Στερεά
Heat of Fusion: 50,21 kJ/mol
Θερμότητα εξάτμισης: 383 kJ/mol
Μοριακή θερμική χωρητικότητα: 19.789 J/mol·K
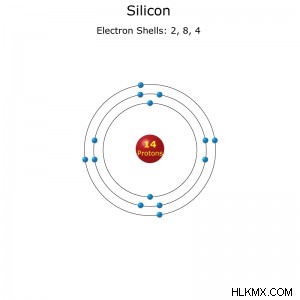
Διαμόρφωση κελύφους ηλεκτρονίων ενός ατόμου πυριτίου.
Ατομικά δεδομένα
Ατομική ακτίνα: 1.11 Å (εμπειρικό)
Ομοιοπολική ακτίνα: 1,11 Å
Ακτίνα Van der Waals: 2.10 Å
Συγγένεια ηλεκτρονίων: 134,068 kJ/mol
Ηλεκτραρνητικότητα: 1,90
1 Ενέργεια ιονισμού: 786,518 kJ/mol
2 Ενέργεια ιονισμού: 1577,134 kJ/mol
3 Ενέργεια ιονισμού: 3231.585 kJ/mol
4 Ενέργεια ιονισμού: 4355,523 kJ/mol
5 Ενέργεια ιονισμού: 16090,571 kJ/mol
6 Ενέργεια ιονισμού: 19805,55 kJ/mol
7 Ενέργεια ιονισμού: 23783,6 kJ/mol
8 Ενέργεια ιονισμού: 29287,16 kJ/mol
Κατάσταση οξείδωσης: +4, -4 (κοινό), +3, +2, +1, -1, -2, -3 (ασυνήθιστο)

Ο Achim Leistner κρατά μια σφαίρα από υπερκαθαρό μονοκρυστάλλο πυριτίου για το Avogadro Project. Πίστωση:Αυστραλιανό Κέντρο Οπτικών Ακριβείας (ACPO)/Οργανισμός Επιστημονικής και Βιομηχανικής Έρευνας της Κοινοπολιτείας (CSIRO)
Διασκεδαστικά στοιχεία για το πυρίτιο
- Το πυρίτιο είναι ένα μπλε-γκρι γυαλιστερό στερεό σε θερμοκρασία δωματίου.
- Τα πυριτικά (οξείδιο του πυριτίου) είναι τα πιο κοινά ορυκτά που βρίσκονται στον φλοιό της Γης. Αυτό κάνει το πυρίτιο να είναι το 2ο πιο άφθονο στοιχείο στον φλοιό.
- Το πυρίτιο είναι το όγδοο πιο άφθονο στοιχείο στο σύμπαν.
- Το πυρίτιο δεν βρίσκεται ελεύθερο στη φύση. Συναντάται συχνότερα με τη μορφή οξειδίου του, πυριτικά. Παραδείγματα περιλαμβάνουν χαλαζία και άμμο, μαζί με τους πολύτιμους λίθους αμέθυστος, αχάτης, ίασπης, οπάλιο και κιτρίνη.
- Το πυρίτιο χρησιμοποιείται κυρίως για γυαλί, κεραμικά και τσιμέντο.
- Το πυρίτιο είναι ένα ζωτικό συστατικό των ημιαγωγών. Σχεδόν κάθε ηλεκτρονικό κύκλωμα περιέχει ημιαγώγιμο υλικό με βάση το πυρίτιο.
- Το Avogadro Project είναι ένα έργο για την παραγωγή μιας τυπικής μάζας κιλών με χρήση ενός μόνο κρυστάλλου πυριτίου. Αυτές οι σφαίρες θεωρούνται τα πιο στρογγυλά ανθρωπογενή αντικείμενα που δημιουργήθηκαν ποτέ.
- Το πυρίτιο εξευγενίζεται εμπορικά με θέρμανση άμμου και άνθρακα σε ηλεκτρικό φούρνο. Το υπερκαθαρό πυρίτιο εξάγεται χρησιμοποιώντας μια τεχνική ηλεκτρόλυσης λιωμένου άλατος.
- Οι σιλικόνες (ενώσεις πυριτίου-οξυγόνου-υδρογονάνθρακα) κυμαίνονται από υγρά έως σκληρά στερεά και έχουν πολλές χρήσιμες ιδιότητες, όπως χρήση ως κόλλες, στεγανωτικά, λιπαντικά και μονωτικά.
- Τα πλάσματα διατόμων απορροφούν πυρίτιο από το νερό και το ενσωματώνουν στα κυτταρικά τους τοιχώματα.
- Οι μετεωρίτες που περιέχουν πυρίτιο είναι γνωστοί ως αερόλιθοι.
Μάθετε περισσότερα σχετικά με τα στοιχεία στον περιοδικό πίνακα.




