Διαφορά μεταξύ Ισεντροπικού και Αδιαβατικού
Κύρια διαφορά – Isentropic vs Adiabatic
Isentropic και adiabatic είναι δύο όροι που χρησιμοποιούνται για να ονομάσουν δύο συγκεκριμένες χημικές διεργασίες που λαμβάνουν χώρα σε θερμοδυναμικά συστήματα. Αυτές οι διεργασίες εξηγούνται χρησιμοποιώντας θερμοδυναμική. Η θερμοδυναμική είναι ο κλάδος της φυσικής επιστήμης που ασχολείται με τις σχέσεις μεταξύ θερμότητας και άλλων μορφών ενέργειας. Η ισοτροπική διαδικασία είναι μια εξιδανικευμένη θερμοδυναμική διαδικασία. Ο όρος ισεντροπικός αναφέρεται στην ύπαρξη σταθερής εντροπίας. Επομένως, μια ισεντροπική διεργασία λαμβάνει χώρα χωρίς αλλαγή της εντροπίας του συστήματος. Από την άλλη πλευρά, η αδιαβατική διεργασία είναι μια θερμοδυναμική διαδικασία στην οποία η θερμότητα δεν χάνεται ούτε κερδίζεται από το θερμοδυναμικό σύστημα. Η ισοτροπική διεργασία είναι ένας τύπος αδιαβατικής διεργασίας. Οι δύο όροι αναφέρονται επίσης στο σύστημα όπου λαμβάνουν χώρα αυτές οι διεργασίες:ισεντροπικό σύστημα και αδιαβατικό σύστημα. Η κύρια διαφορά μεταξύ Ισεντροπικού και αδιαβατικού είναι ότι ισεντροπικό σημαίνει σταθερή εντροπία ενώ αδιαβατικό σημαίνει σταθερή θερμική ενέργεια.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Isentropic
– Ορισμός, Εξήγηση με Θερμοδυναμική
2. Τι είναι το Αδιαβατικό
– Ορισμός, Διαδικασία, Σύστημα
3. Ποιες είναι οι ομοιότητες μεταξύ Ισεντροπικού και Αδιαβατικού
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ Ισεντροπικού και Αδιαβατικού
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Αδιαβατικό, Ενέργεια, Εντροπία, Θερμότητα, Ισεντροπικό, Σύστημα, Θερμοδυναμική

Τι είναι το Isentropic
Ο όρος ισεντροπικός χρησιμοποιείται για να ονομάσει είτε μια θερμοδυναμική διεργασία είτε ένα σύστημα όπου λαμβάνει χώρα μια ισεντροπική διεργασία. Μια ισεντροπική διεργασία είναι μια διαδικασία όπου η εντροπία του συστήματος παραμένει σταθερή χωρίς μη αναστρεψιμότητα και μεταφορά θερμότητας. Αυτό σημαίνει ότι η εντροπία του θερμοδυναμικού συστήματος παραμένει η ίδια στο τέλος της διαδικασίας. Αυτή η διαδικασία είναι ένας τύπος αδιαβατικής διαδικασίας. Μπορεί να εξηγηθεί ως αναστρέψιμη αδιαβατική διαδικασία.
Μια ισεντροπική διεργασία διατηρεί σταθερά την εντροπία, την ισορροπία και τη θερμική ενέργεια. Αυτή η διαδικασία χαρακτηρίζεται από,
ΔS = 0 ή S1 = S2
ΔS είναι η αλλαγή στην εντροπία και το S1 , S2 είναι αρχικές και τελικές εντροπίες του συστήματος. Μερικά παραδείγματα θεωρητικών ισοεντροπικών συστημάτων είναι οι αντλίες, οι τουρμπίνες, οι συμπιεστές αερίου κ.λπ.
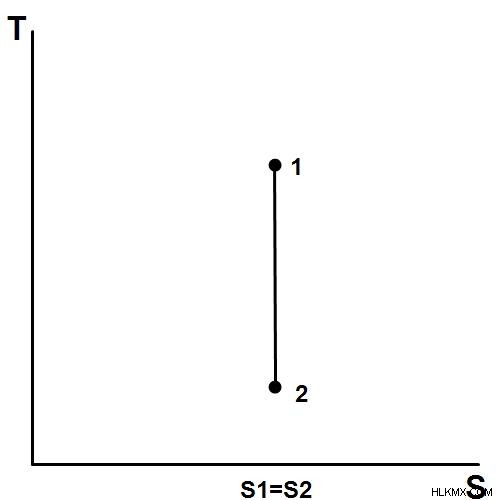
Εικόνα 1:Η εντροπία είναι σταθερή για ισοτροπικά συστήματα
Σύμφωνα με τον δεύτερο νόμο της θερμοδυναμικής,
dS = dQ/T
dS είναι η αλλαγή στην εντροπία, dQ είναι η αλλαγή στη θερμική ενέργεια ή η μεταφορά θερμότητας και T είναι η θερμοκρασία. Προκειμένου να διατηρηθεί μια σταθερή εντροπία, δεν πραγματοποιείται μεταφορά θερμότητας μεταξύ του συστήματος και του περιβάλλοντός του (γιατί σύμφωνα με τον παραπάνω νόμο, η αύξηση της ενέργειας αυξάνει την εντροπία) και η εργασία που γίνεται στο σύστημα θα πρέπει να είναι χωρίς τριβή (η τριβή στο εσωτερικό σύστημα δημιουργεί εντροπία).
Τι είναι το Adiabatic
Αδιαβατικό σημαίνει σταθερή θερμική ενέργεια και μπορεί να χρησιμοποιηθεί για την ονομασία μιας θερμοδυναμικής διεργασίας ή ενός συστήματος όπου λαμβάνει χώρα η αδιαβατική διεργασία. Η αδιαβατική διεργασία είναι μια θερμοδυναμική διαδικασία που λαμβάνει χώρα χωρίς καμία μεταφορά θερμότητας μεταξύ ενός συστήματος και του περιβάλλοντός του. Εδώ, είτε θερμότητα είτε ύλη δεν μεταφέρεται μέσα ή έξω από το σύστημα. Επομένως, σε μια αδιαβατική διαδικασία, ο μόνος τρόπος μεταφοράς ενέργειας μεταξύ ενός συστήματος και του περιβάλλοντός του είναι ως έργο.
Μια αδιαβατική διαδικασία μπορεί να διατηρηθεί εκτελώντας γρήγορα τη διαδικασία. Για παράδειγμα, εάν συμπιέσουμε γρήγορα ένα αέριο σε έναν κύλινδρο, δεν υπάρχει αρκετός χρόνος για το σύστημα να μεταφέρει θερμική ενέργεια στο περιβάλλον. Στις αδιαβατικές διεργασίες, η εργασία που γίνεται από το σύστημα αλλάζει την εσωτερική ενέργεια του συστήματος.
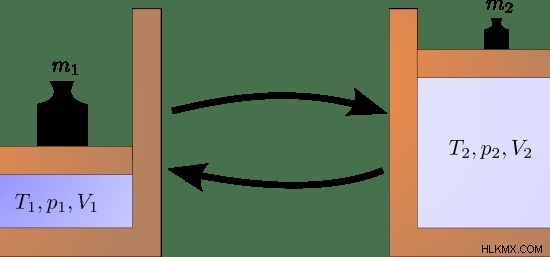
Εικόνα 2:Αδιαβατική αναστρέψιμη αλλαγή κατάστασης
Ένα αδιαβατικό σύστημα είναι ένα σύστημα που δεν έχει καμία ανταλλαγή ενέργειας ή ύλης με το περιβάλλον. Αυτό σημαίνει ότι η ενέργεια δεν χάνεται ούτε κερδίζεται από το αδιαβατικό σύστημα. Αυτά τα συστήματα είναι γνωστό ότι είναι αδιαβατικά απομονωμένα συστήματα. Σύμφωνα με τον πρώτο νόμο της θερμοδυναμικής,
∆U = Q – W
U είναι η εσωτερική ενέργεια του συστήματος, Q είναι η ενέργεια που ανταλλάσσεται μεταξύ του συστήματος και το περιβάλλον του, W είναι το έργο που κάνει το σύστημα στο περιβάλλον του.
Για ένα αδιαβατικό σύστημα, Q =0.
Στη συνέχεια,
∆U = – W
Αν θεωρήσουμε ένα σύστημα που αποτελείται από ένα μείγμα αερίων που λειτουργούν ως αδιαβατικό σύστημα όταν διαστέλλεται, η τιμή του W είναι θετική και η εσωτερική ενέργεια μειώνεται . Αλλά αν το σύστημα συστέλλεται, η τιμή του W είναι αρνητική και η εσωτερική ενέργεια αυξάνεται. Αυτό δείχνει ότι η ενέργεια σε μια αδιαβατική διαδικασία μεταφέρεται στο περιβάλλον της μόνο ως έργο. Ορισμένα συστήματα με ορισμένες χημικές αντιδράσεις μπορούν να θεωρηθούν κατά προσέγγιση ως αδιαβατικά συστήματα επειδή αυτές οι αντιδράσεις συμβαίνουν γρήγορα, χωρίς να τους δίνεται αρκετός χρόνος για να απελευθερώσει ενέργεια έξω ή να αποκτήσει ενέργεια από έξω.
Ομοιότητες μεταξύ Isentropic και Adiabatic
- Και οι δύο είναι θερμοδυναμικές διεργασίες.
- Η ισοτροπική είναι επίσης ένας τύπος αδιαβατικής διεργασίας.
Διαφορά μεταξύ Ισεντροπικού και Αδιαβατικού
Ορισμός
Isentropic: Ισεντροπικό σημαίνει σταθερή εντροπία.
Αδιαβατικό: Αδιαβατικό σημαίνει σταθερή θερμική ενέργεια.
Διαδικασία
Isentropic: Μια ισεντροπική διεργασία είναι μια διαδικασία κατά την οποία η εντροπία του συστήματος παραμένει σταθερή χωρίς μη αναστρέψιμότητα και μεταφορά θερμότητας.
Αδιαβατικό: Η αδιαβατική διεργασία είναι μια θερμοδυναμική διαδικασία που λαμβάνει χώρα χωρίς καμία μεταφορά θερμότητας μεταξύ ενός συστήματος και του περιβάλλοντός του.
Εντροπία
Isentropic: Η εντροπία είναι σταθερή για ισεντροπικές διεργασίες ή συστήματα.
Αδιαβατικό: Η εντροπία δεν είναι σταθερή για αδιαβατικές διεργασίες ή συστήματα.
Σταθερές παράμετροι
Isentropic: Για ισεντροπικές διεργασίες ή συστήματα, η εντροπία, η ισορροπία και η θερμική ενέργεια είναι σταθερές.
Αδιαβατικό: Για αδιαβατικές διεργασίες ή συστήματα, η θερμική ενέργεια είναι σταθερή.
Αναστρεψιμότητα
Isentropic: Οι ισοτροπικές διεργασίες είναι αναστρέψιμες.
Αδιαβατικό: Οι αδιαβατικές διεργασίες είναι είτε αναστρέψιμες είτε μη αναστρέψιμες.
Συμπέρασμα
Οι δύο όροι Isentropic και Adiabatic χρησιμοποιούνται για να ονομάσουν είτε θερμοδυναμικές διεργασίες είτε συστήματα όπου λαμβάνουν χώρα αυτές οι διεργασίες. Η κύρια διαφορά μεταξύ ισεντροπικού και αδιαβατικού είναι ότι ισεντροπικό σημαίνει σταθερή εντροπία ενώ αδιαβατικό σημαίνει σταθερή θερμική ενέργεια.




