Πολικά και μη πολικά μόρια
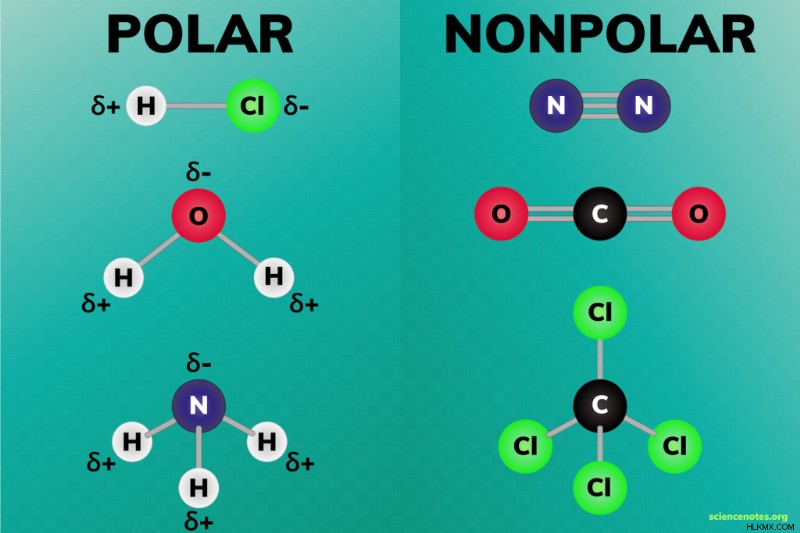
Τα πολικά και τα μη πολικά μόρια είναι οι δύο ευρείες κατηγορίες μορίων. Η πολικότητα περιγράφει την κατανομή του ηλεκτρικού φορτίου γύρω από ένα μόριο. Το φορτίο κατανέμεται ομοιόμορφα σε ένα μη πολικό μόριο, αλλά άνισα κατανεμημένο σε ένα πολικό μόριο. Με άλλα λόγια, ένα πολικό μόριο έχει περιοχές μερικού φορτίου.
Ακολουθούν παραδείγματα πολικών και μη πολικών μορίων, μια ματιά στο πώς η πολικότητα σχετίζεται με τους ιοντικούς και τους ομοιοπολικούς δεσμούς και πώς μπορείτε να χρησιμοποιήσετε την πολικότητα για να προβλέψετε ποια μόρια θα αναμειχθούν.
- Σχηματίζονται μη πολικοί δεσμοί μεταξύ δύο μη μετάλλων με την ίδια τιμή ηλεκτραρνητικότητας.
- Σχηματίζονται πολικοί δεσμοί μεταξύ ατόμων στοιχείων με διαφορετικές τιμές ηλεκτραρνητικότητας.
- Τα μη πολικά μόρια μπορεί να περιέχουν οποιονδήποτε τύπο χημικών δεσμών, αλλά τα μερικά φορτία αλληλοεξουδετερώνονται.
- Τα πολικά μόρια περιέχουν πολικούς ομοιοπολικούς ή ιοντικούς δεσμούς που είναι διατεταγμένοι έτσι ώστε τα μερικά φορτία τους να μην αλληλοεξουδετερώνονται.
Πολικοί και μη πολικοί χημικοί δεσμοί
Η κατανόηση και η αναγνώριση των πολικών και μη πολικών χημικών δεσμών διευκολύνει την κατανόηση των πολικών μορίων. Σε έναν πολικό δεσμό, το ένα άτομο έχει μερικό θετικό ηλεκτρικό φορτίο, ενώ το άλλο άτομο έχει μερικό αρνητικό ηλεκτρικό φορτίο. Με άλλα λόγια, ένας πολικός δεσμός σχηματίζει ένα ηλεκτρικό δίπολο. Σε έναν μη πολικό δεσμό, τα άτομα μοιράζονται ηλεκτρόνια εξίσου, οπότε δεν υπάρχει μερικό θετικό ή αρνητικό φορτίο μεταξύ τους. Το αν τα άτομα σχηματίζουν πολικούς ή μη πολικούς δεσμούς εξαρτάται από τη διαφορά μεταξύ των τιμών ηλεκτραρνητικότητας τους.
- Μη πολικός δεσμός :Σχηματίζονται μη πολικοί δεσμοί μεταξύ δύο ατόμων με ίδιες τιμές ηλεκτραρνητικότητας. Αυτός ο τύπος δεσμού είναι ένας καθαρός ομοιοπολικός δεσμός. Για παράδειγμα, δύο άτομα υδρογόνου σχηματίζουν έναν μη πολικό δεσμό.
- Πολικός δεσμός :Εάν οι τιμές ηλεκτραρνητικότητας μεταξύ δύο ατόμων είναι κοντινές αλλά όχι ίδιες, τα άτομα σχηματίζουν έναν πολικό ομοιοπολικό δεσμό. Οι πολικοί ομοιοπολικοί δεσμοί σχηματίζονται μεταξύ δύο διαφορετικών μη μετάλλων. Για παράδειγμα, το υδρογόνο (ηλεκτραρνητικότητα =2,1) και το χλώριο (ηλεκτραρνητικότητα =3,0) σχηματίζουν έναν πολικό ομοιοπολικό δεσμό. Εάν οι τιμές ηλεκτραρνητικότητας είναι πολύ διαφορετικές, τα άτομα σχηματίζουν έναν πολικό δεσμό που ονομάζεται ιονικός δεσμός. Σχηματίζονται ιονικοί δεσμοί μεταξύ μετάλλων και μη μετάλλων.
Ο πιο πολικός δεσμός είναι ένας ιοντικός δεσμός. Ένας πολικός ομοιοπολικός δεσμός είναι ελαφρώς πολικός. Ένας καθαρός ομοιοπολικός δεσμός είναι μη πολικός.
Πολικά μόρια
Ένα πολικό μόριο έχει ένα δίπολο, όπου μέρος του μορίου έχει μερικό θετικό φορτίο και μέρος έχει μερικό αρνητικό φορτίο. Τα διατομικά ιοντικά και πολικά ομοιοπολικά μόρια είναι πολικά μόρια. Όμως, τα μόρια που περιέχουν περισσότερα από δύο άτομα μπορεί επίσης να είναι πολικά. Ένα πολικό μόριο έχει ασύμμετρο σχήμα, μοναχικό ζεύγος ηλεκτρονίων ή κεντρικό άτομο συνδεδεμένο με άλλα άτομα με διαφορετικές τιμές ηλεκτραρνητικότητας. Συνήθως, ένα πολικό μόριο περιέχει ιοντικούς ή πολικούς ομοιοπολικούς δεσμούς. Παραδείγματα πολικών μορίων περιλαμβάνουν:
- Νερό – H2 O
- Αμμωνία – NH3
- Διοξείδιο του θείου – SO2
- Υδρόθειο – H2 S
- Μονοξείδιο του άνθρακα – CO
- Όζον – O3
- Υδροφθορικό οξύ – HF (και άλλα μόρια με ένα μόνο Η)
- Αιθανόλη – C2 H6 O (και άλλες αλκοόλες με ΟΗ στο ένα άκρο)
- Σακχαρόζη – C12 H22 O11 (και άλλα σάκχαρα με ομάδες ΟΗ)
Τα πολικά μόρια είναι συχνά υδρόφιλα και διαλυτά σε πολικούς διαλύτες. Τα πολικά μόρια έχουν συχνά υψηλότερα σημεία τήξης από τα μη πολικά μόρια με παρόμοιες μοριακές μάζες. Αυτό οφείλεται σε διαμοριακές δυνάμεις μεταξύ πολικών μορίων, όπως οι δεσμοί υδρογόνου.
Μη πολικά μόρια
Τα μη πολικά μόρια σχηματίζονται είτε όταν τα ηλεκτρόνια μοιράζονται ισότιμα μεταξύ των ατόμων ενός μορίου είτε όταν η διάταξη των ηλεκτρονίων σε ένα μόριο είναι συμμετρική έτσι ώστε τα διπολικά φορτία να αλληλοεξουδετερώνονται. Παραδείγματα μη πολικών μορίων περιλαμβάνουν:
- Οποιοδήποτε από τα ευγενή αέρια:He, Ne, Ar, Kr, Xe (Αν και τεχνικά αυτά είναι άτομα και όχι μόρια.)
- Οποιοδήποτε από τα ομοπυρηνικά διατομικά στοιχεία:H2 , N2 , O2 , Cl2 (Αυτά είναι πραγματικά μη πολικά μόρια.)
- Διοξείδιο του άνθρακα – CO2
- Τριφθοριούχο βόριο – BF3
- Βενζόλιο – C6 H6
- Τετραχλωριούχος άνθρακας – CCl4
- Μεθάνιο – CH4
- Αιθυλένιο – C2 H4
- Υγρά υδρογονανθράκων, όπως βενζίνη και τολουόλιο
- Τα περισσότερα οργανικά μόρια, με εξαιρέσεις (όπως αλκοόλες και σάκχαρα)
Τα μη πολικά μόρια μοιράζονται μερικές κοινές ιδιότητες. Τείνουν να είναι αδιάλυτα στο νερό σε θερμοκρασία δωματίου, υδρόφοβα και ικανά να διαλύουν άλλες μη πολικές ενώσεις.
Μη πολικά μόρια με πολικούς δεσμούς
Η πολικότητα εξαρτάται από τις σχετικές τιμές ηλεκτραρνητικότητας μεταξύ δύο ατόμων που σχηματίζουν έναν χημικό δεσμό. Δύο άτομα με τις ίδιες τιμές ηλεκτραρνητικότητας σχηματίζουν ομοιοπολικό δεσμό. Τα ηλεκτρόνια μοιράζονται ομοιόμορφα μεταξύ των ατόμων σε έναν ομοιοπολικό δεσμό, επομένως ο δεσμός είναι μη πολικός. Άτομα με ελαφρώς διαφορετικές τιμές ηλεκτραρνητικότητας σχηματίζουν πολικούς ομοιοπολικούς δεσμούς. Όταν οι τιμές ηλεκτραρνητικότητας μεταξύ των ατόμων είναι πολύ διαφορετικές, σχηματίζονται ιοντικοί δεσμοί. Οι ιοντικοί δεσμοί είναι εξαιρετικά πολικοί.
Συχνά, η πολικότητα των δεσμών είναι ίδια με την πολικότητα του μορίου. Ωστόσο, υπάρχουν μη πολικά μόρια με πολικούς δεσμούς και πολικά μόρια με μη πολικούς δεσμούς! Για παράδειγμα, το τριφθοριούχο βόριο είναι ένα μη πολικό μόριο που περιέχει πολικούς ομοιοπολικούς δεσμούς. BF3 είναι ένα τριγωνικό επίπεδο μόριο που κατανέμει ομοιόμορφα το ηλεκτρικό φορτίο γύρω από το μόριο, παρόλο που ο δεσμός μεταξύ των ατόμων βορίου και φθορίου είναι πολικός. Το όζον είναι ένα παράδειγμα πολικού μορίου που αποτελείται από μη πολικούς ομοιοπολικούς δεσμούς. Οι χημικοί δεσμοί μεταξύ των μορίων οξυγόνου στο O3 είναι αμιγώς ομοιοπολικά επειδή τα άτομα έχουν ίδιες τιμές ηλεκτραρνητικότητας. Ωστόσο, το μόριο του όζοντος έχει λυγισμένο σχήμα (όπως το νερό) και τα ηλεκτρόνια του δεν περνούν ίσο χρόνο και με τα τρία άτομα. Το μεσαίο άτομο έχει μερικό θετικό ηλεκτρικό φορτίο, ενώ τα δύο εξωτερικά άτομα φέρουν ένα μερικό αρνητικό φορτίο.
Πολικότητα και αναμειξιμότητα
Μπορείτε να χρησιμοποιήσετε την πολικότητα για να προβλέψετε εάν δύο ενώσεις είναι αναμίξιμες ή όχι (θα αναμειχθούν για να σχηματίσουν ένα διάλυμα). Ο εμπειρικός κανόνας είναι ότι «το όμοιο διαλύει το όμοιο». Αυτό σημαίνει ότι οι πολικοί διαλύτες διαλύουν τις πολικές διαλυμένες ουσίες, ενώ οι μη πολικοί διαλύτες διαλύουν τις μη πολικές διαλυμένες ουσίες. Αυτό εξηγεί γιατί το αλκοόλ και το νερό είναι εντελώς αναμίξιμα (και τα δύο πολικά) και γιατί το λάδι και το νερό δεν αναμειγνύονται (μη πολικά με πολικά).
Μια ένωση με ενδιάμεση πολικότητα μεταξύ ενός μορίου και ενός άλλου μπορεί να λειτουργήσει ως ενδιάμεσος για τη διάλυση μιας χημικής ουσίας σε έναν διαλύτη όταν είναι κανονικά αδιάλυτη. Για παράδειγμα, για να αναμίξετε μια ιοντική ή πολική ένωση σε έναν οργανικό μη πολικό διαλύτη, μπορείτε πρώτα να τη διαλύσετε σε αιθανόλη. Η αιθανόλη είναι μόνο ελαφρώς πολική, αλλά συχνά αρκεί για να διαλύσει τη διαλυμένη ουσία. Αφού διαλυθεί το πολικό μόριο, αναμίξτε το διάλυμα αιθανόλης σε έναν μη πολικό οργανικό διαλύτη, όπως ξυλόλιο ή βενζόλιο.
Αναφορές
- Ingold, C. K.; Ingold, E. H. (1926). «Η φύση της εναλλασσόμενης επίδρασης στις αλυσίδες άνθρακα. Μέρος V. Συζήτηση για την αρωματική υποκατάσταση με ειδική αναφορά στους αντίστοιχους ρόλους της πολικής και μη πολικής διάστασης. και Περαιτέρω Μελέτη της Σχετικής Οδηγίας Αποδόσεις Οξυγόνου και Αζώτου». J. Chem. Soc .:1310–1328. doi:10.1039/jr9262901310
- Mack, Kenneth M.; Muenter, J. S. (1977). «Ιδιότητες Stark και Zeeman του όζοντος από φασματοσκοπία μοριακής δέσμης». Journal of Chemical Physics . 66 (12):5278–5283. doi:10.1063/1.433909
- Pauling, L. (1960). Η φύση του χημικού δεσμού (3η έκδ.). Oxford University Press. ISBN 0801403332.
- Ziaei-Moayyed, Maryam; Goodman, Edward; Williams, Peter (1 Νοεμβρίου 2000). «Ηλεκτρική εκτροπή ροών πολικού υγρού:Μια παρεξηγημένη επίδειξη». Journal of Chemical Education . 77 (11):1520. doi:10.1021/ed077p1520




