Διάγραμμα φορτίων στοιχείων – Πώς να γνωρίζετε το φορτίο ενός ατόμου
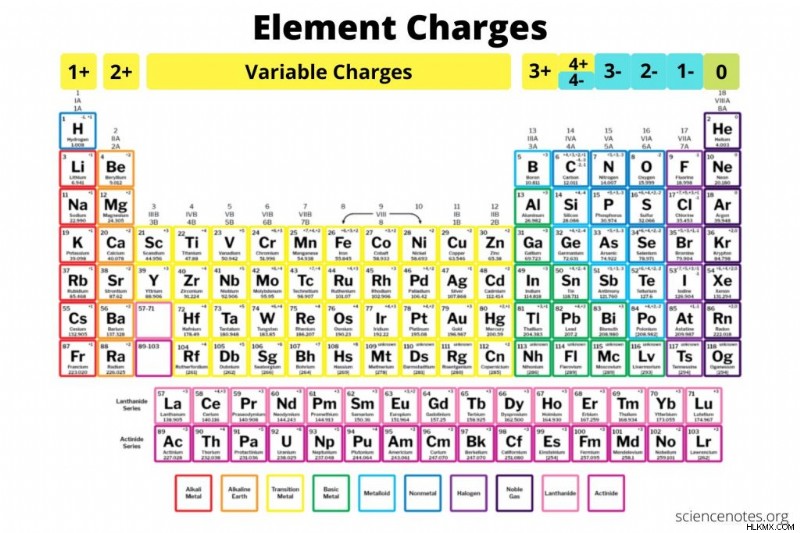
Ακολουθεί ένα διάγραμμα χρεώσεων στοιχείων και μια εξήγηση για το πώς να βρείτε τη χρέωση ενός στοιχείου εάν δεν το γνωρίζετε. Η διαφορά μεταξύ φορτίου, κατάστασης οξείδωσης και σθένους εξηγείται επίσης. Μπορείτε να κατεβάσετε και να εκτυπώσετε αυτά τα γραφικά και τους πίνακες για αναφορές.
Πώς να βρείτε το φορτίο ενός στοιχείου
Υπάρχουν τέσσερις τρόποι για να βρείτε τη φόρτιση ενός στοιχείου:
- Χρησιμοποιήστε τον περιοδικό πίνακα. Η συνήθης φόρτιση ενός στοιχείου είναι κοινή για την ομάδα του.
Όμιλος 1 (Μέταλλα Αλκαλίων) :1+
Ομάδα 2 (Μέταλλα Αλκαλικής Γης) :2+
Ομάδες 3-12 (Μέταλλα μετάβασης) :Μεταβλητά θετικά φορτία
Σειρά λανθανίδης και ακτινίδης :Μεταβλητά θετικά φορτία
Ομάδα 13 :3+
Ομάδα 14 :4+ ή 4-
Ομάδα 15 :3-
Ομάδα 16 :2-
Ομάδα 17 (Αλογόνα):1-
Ομάδα 18 (ευγενή αέρια):0
- Χρησιμοποιήστε ένα γράφημα. Τα γραφήματα προέρχονται από εμπειρικά δεδομένα σχετικά με την πραγματική συμπεριφορά των στοιχείων, τα οποία μπορεί να διαφέρουν κάπου από τις προβλέψεις του περιοδικού πίνακα. Εδώ είναι δύο γραφήματα. Η πρώτη εμφανίζει τις χρεώσεις κοινών στοιχείων, ενώ η δεύτερη δείχνει όλες τις χρεώσεις στοιχείων για τα πρώτα 45 στοιχεία (οι πιο συνηθισμένες χρεώσεις με έντονους χαρακτήρες).
- Για ένα μεμονωμένο άτομο, το φορτίο είναι ο αριθμός των πρωτονίων μείον τον αριθμό των ηλεκτρονίων.
- Βρείτε το φορτίο εξισορροπώντας το φορτίο σε μια ένωση.
| Αριθμός | Στοιχείο | Χρέωση |
|---|---|---|
| 1 | υδρογόνο | 1+ |
| 2 | ηλίου | 0 |
| 3 | λίθιο | 1+ |
| 4 | βηρύλλιο | 2+ |
| 5 | βόριο | 3-, 3+ |
| 6 | άνθρακας | 4+ |
| 7 | άζωτο | 3- |
| 8 | οξυγόνο | 2- |
| 9 | φθόριο | 1- |
| 10 | νέον | 0 |
| 11 | νάτριο | 1+ |
| 12 | μαγνήσιο | 2+ |
| 13 | αλουμίνιο | 3+ |
| 14 | πυρίτιο | 4+, 4- |
| 15 | φώσφορος | 5+, 3+, 3- |
| 16 | θείο | 2-, 2+, 4+, 6+ |
| 17 | χλώριο | 1- |
| 18 | αργόν | 0 |
| 19 | κάλιο | 1+ |
| 20 | ασβέστιο | 2+ |
| 21 | σκάνδιο | 3+ |
| 22 | τιτάνιο | 4+, 3+ |
| 23 | βανάδιο | 2+, 3+, 4+, 5+ |
| 24 | χρώμιο | 2+, 3+, 6+ |
| 25 | μαγγάνιο | 2+, 4+, 7+ |
| 26 | σίδερο | 2+, 3+ |
| 27 | κοβάλτιο | 2+, 3+ |
| 28 | νικέλιο | 2+ |
| 29 | χαλκός | 1+, 2+ |
| 30 | ψευδάργυρος | 2+ |
| 31 | γάλλιο | 3+ |
| 32 | γερμάνιο | 4-, 2+, 4+ |
| 33 | αρσενικό | 3-, 3+, 5+ |
| 34 | σελήνιο | 2-, 4+, 6+ |
| 35 | βρώμιο | 1-, 1+, 5+ |
| 36 | κρυπτόν | 0 |
| 37 | ρουβίδιο | 1+ |
| 38 | στρόντιο | 2+ |
| 39 | ύττριο | 3+ |
| 40 | ζιρκόνιο | 4+ |
| 41 | νιόβιο | 3+, 5+ |
| 42 | μολυβδαίνιο | 3+, 6+ |
| 43 | τεχνήτιο | 6+ |
| 44 | ρουθήνιο | 3+, 4+, 8+ |
| 45 | ρόδιο | 4+ |
| 46 | παλλάδιο | 2+, 4+ |
| 47 | ασημί | 1+ |
| 48 | κάδμιο | 2+ |
| 49 | ίνδιο | 3+ |
| 50 | tin | 2+, 4+ |
| 51 | αντιμόνιο | 3-, 3+, 5+ |
| 52 | τελλούριο | 2-, 4+, 6+ |
| 53 | ιώδιο | 1- |
| 54 | xenon | 0 |
| 55 | καισίου | 1+ |
| 56 | βάριο | 2+ |
| 57 | λανθάνιο | 3+ |
| 58 | δημήτριο | 3+, 4+ |
| 59 | πρασεοδύμιο | 3+ |
| 60 | νεοδύμιο | 3+, 4+ |
| 61 | προμέθιο | 3+ |
| 62 | σαμάρι | 3+ |
| 63 | ευρώπιο | 3+ |
| 64 | γαδολίνιο | 3+ |
| 65 | terbium | 3+, 4+ |
| 66 | δυσπρόσιο | 3+ |
| 67 | χόλμιο | 3+ |
| 68 | έρβιο | 3+ |
| 69 | θούλιο | 3+ |
| 70 | υττέρβιο | 3+ |
| 71 | λουτέτιο | 3+ |
| 72 | hafnium | 4+ |
| 73 | ταντάλιο | 5+ |
| 74 | βολφράμιο | 6+ |
| 75 | ρήνιο | 2+, 4+, 6+, 7+ |
| 76 | όσμιο | 3+, 4+, 6+, 8+ |
| 77 | ιρίδιο | 3+, 4+, 6+ |
| 78 | πλατινένιο | 2+, 4+, 6+ |
| 79 | χρυσός | 1+, 2+, 3+ |
| 80 | υδράργυρος | 1+, 2+ |
| 81 | θάλλιο | 1+, 3+ |
| 82 | προηγείται | 2+, 4+ |
| 83 | βισμούθιο | 3+ |
| 84 | πολώνιο | 2+, 4+ |
| 85 | αστατίνη | ? |
| 86 | ραδόνιο | 0 |
| 87 | φράγκιο | ? |
| 88 | ράδιο | 2+ |
| 89 | ακτίνιο | 3+ |
| 90 | θόριο | 4+ |
| 91 | πρωτακτίνιο | 5+ |
| 92 | ουράνιο | 3+, 4+, 6+ |


Τι είναι οι αριθμοί οξείδωσης;
Όταν μιλάμε για το φορτίο ενός ατόμου, είναι συνήθως ο αριθμός οξείδωσής του και όχι το σθένος του.
Φόρτιση, σθένος και κατάσταση οξείδωσης
Σε πολλά κείμενα, οι όροι φορτίο (ή επίσημο φορτίο), σθένος και αριθμός οξείδωσης χρησιμοποιούνται εναλλακτικά. Αυτοί οι τρεις όροι σχετίζονται, αλλά έχουν ελαφρώς διαφορετικούς ορισμούς:
- Χρέωση (Τυπική χρέωση) :Φορτίο είναι το ηλεκτρικό φορτίο ενός ατόμου όταν όλοι οι συνδέτες του αφαιρούνται ομολυτικά. Στην ομολυτική διάσπαση, τα ηλεκτρόνια που μοιράζονται έναν δεσμό χωρίζονται εξίσου μεταξύ των δύο ατόμων.
- Κατάσταση οξείδωσης (Αριθμός οξείδωσης) :Κατάσταση οξείδωσης είναι το φορτίο ενός ατόμου όταν όλοι οι συνδέτες του αφαιρούνται ετερολυτικά. Σε αυτήν την περίπτωση, το πιο ηλεκτραρνητικό άτομο παίρνει τα ηλεκτρόνια.
- Σθένος :Το σθένος είναι ο αριθμός των ηλεκτρονίων που χρησιμοποιούνται από ένα άτομο για να σχηματίσει έναν χημικό δεσμό.
Ταραγμένος? Συνήθως, αυτό που θέλετε να μάθετε είναι η κατάσταση οξείδωσης, η οποία φέρει και έναν αριθμό και ένα θετικό ή αρνητικό πρόσημο. Για παράδειγμα, στο HCl, τόσο το H όσο και το Cl έχουν σθένος 1. Ένα ηλεκτρόνιο από κάθε άτομο συμμετέχει στο σχηματισμό χημικών δεσμών. Όμως, το υδρογόνο έχει κατάσταση οξείδωσης +1, ενώ το χλώριο έχει κατάσταση οξείδωσης -1. Από την κατάσταση οξείδωσης, γνωρίζετε το φορτίο (ή το αντίστροφο). Γράφουμε τα φορτία των ατόμων ως H και Cl.
Αναφορές
- Karen, P.; McArdle, Ρ.; Takats, J. (2016). «Συνολικός ορισμός της κατάστασης οξείδωσης (IUPAC Recommendations 2016)». Pure Appl. Chem . 88 (8):831–839. doi:10.1515/pac-2015-1204
- Parkin, Gerard (Μάιος 2006). «Σθένος, αριθμός οξείδωσης και επίσημο φορτίο:τρεις σχετικές αλλά θεμελιωδώς διαφορετικές έννοιες». Journal of Chemical Education . 83 (5):791. doi:10.1021/ed083p791