Τι είναι η ενέργεια ιονισμού; Ορισμός και τάση
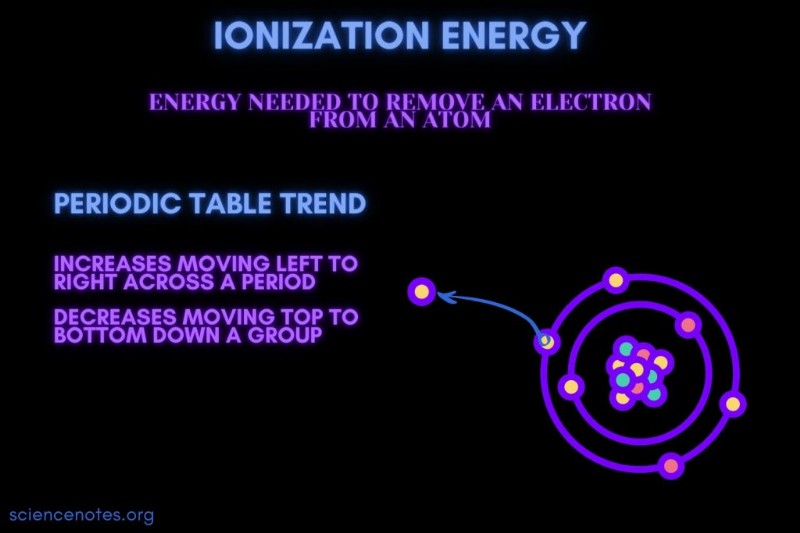
Εξ ορισμού, ενέργεια ιονισμού είναι η ελάχιστη ενέργεια που απαιτείται για την αφαίρεση του πιο χαλαρά δεσμευμένου ηλεκτρονίου από ένα αέριο άτομο ή ιόν. Ο όρος γράφεται επίσης ως ενέργεια ιονισμού (Βρετανικά Αγγλικά). Η ενέργεια ιονισμού συμβολίζεται με τα σύμβολα IE, IP, ΔH° και έχει μονάδες kilojoule ανά mol ((kJ/mol) ή ηλεκτρονιοβολτ (eV).
Η ενέργεια ιοντισμού είναι η ενέργεια που απαιτείται για την απομάκρυνση ενός ηλεκτρονίου από ένα άτομο ή ιόν.
Η ενέργεια ιοντισμού αυξάνεται κατά τη διάρκεια μιας περιόδου και μειώνεται κινούμενος προς τα κάτω σε μια ομάδα. Υπάρχουν εξαιρέσεις σε αυτή την τάση του περιοδικού πίνακα.
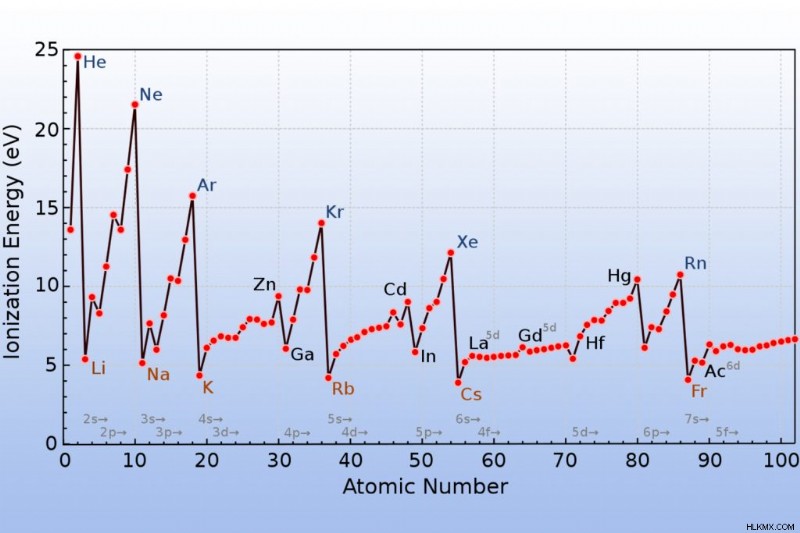
Το φράγκιο (ένα αλκαλικό μέταλλο) έχει τη χαμηλότερη ενέργεια ιονισμού, ενώ το ήλιο (ένα ευγενές αέριο) έχει την υψηλότερη ενέργεια ιοντισμού.
Η πρώτη ενέργεια ιοντισμού είναι η χαμηλότερη. Η αφαίρεση κάθε επόμενου ηλεκτρονίου απαιτεί περισσότερη ενέργεια.
Σημασία της Ενέργειας Ιοντισμού
Η ενέργεια ιοντισμού αντανακλά πόσο δύσκολο είναι να αφαιρεθεί ένα ηλεκτρόνιο από ένα άτομο, επομένως είναι ένας χρήσιμος προγνωστικός δείκτης της αντιδραστικότητας και της ισχύος των χημικών δεσμών που σχηματίζει το άτομο. Όσο μεγαλύτερη είναι η ενέργεια ιονισμού, τόσο πιο δύσκολο είναι να αφαιρεθεί ένα ηλεκτρόνιο. Έτσι, τα άτομα με χαμηλές ενέργειες ιονισμού (όπως τα αλκαλικά μέταλλα) τείνουν να είναι εξαιρετικά αντιδραστικά και να σχηματίζουν εύκολα χημικούς δεσμούς. Τα άτομα με υψηλές ενέργειες ιονισμού (όπως τα ευγενή αέρια) εμφανίζουν χαμηλή αντιδραστικότητα και είναι λιγότερο πιθανό να σχηματίσουν χημικούς δεσμούς και ενώσεις.
Τάση ενέργειας ιονισμού στον περιοδικό πίνακα

Το στοιχείο με την υψηλότερη ενέργεια ιονισμού είναι το ήλιο, το οποίο βρίσκεται στην επάνω δεξιά πλευρά του περιοδικού πίνακα και είναι ένα από τα ευγενή αέρια. Το φράγκιο, ένα αλκαλικό μέταλλο που βρίσκεται στο κάτω αριστερό μέρος του πίνακα, έχει μία από τις χαμηλότερες ενέργειες ιονισμού. Η ενέργεια ιοντισμού εμφανίζει μια τάση στον περιοδικό πίνακα.
- Η ενέργεια ιονισμού γενικά αυξάνεται μετακινούμενος από αριστερά προς τα δεξιά σε μια περίοδο στοιχείου (σειρά). Ο λόγος είναι ότι η ατομική ακτίνα τείνει να μειώνεται κινούμενος σε μια περίοδο. Αυτό συμβαίνει επειδή προστίθενται περισσότερα πρωτόνια, αυξάνοντας την έλξη μεταξύ του πυρήνα και των ηλεκτρονίων και τραβώντας τα κελύφη των ηλεκτρονίων πιο κοντά.
- Η ενέργεια ιονισμού γενικά μειώνεται κινούμενος από πάνω προς τα κάτω σε μια ομάδα στοιχείων (στήλη). Ο λόγος είναι ότι ο κύριος κβαντικός αριθμός του εξώτατου ηλεκτρονίου (σθένους) αυξάνεται κινούμενος προς τα κάτω. Τα άτομα έχουν περισσότερα πρωτόνια που κινούνται προς τα κάτω σε μια ομάδα, η οποία έλκει τα ηλεκτρονιακά κελύφη. Όμως, κάθε σειρά προσθέτει ένα νέο κέλυφος, έτσι τα εξώτατα ηλεκτρόνια βρίσκονται ακόμη πιο μακριά από τον πυρήνα.
Εξαιρέσεις στην τάση
Υπάρχουν ορισμένες εξαιρέσεις στην τάση ιονισμού ενέργειας. Για παράδειγμα, η πρώτη ενέργεια ιοντισμού του βορίου είναι χαμηλότερη από την ενέργεια πρώτου ιοντισμού του βηρυλλίου. Η ενέργεια ιοντισμού του οξυγόνου είναι μικρότερη από αυτή του αζώτου. Εξαιρέσεις συμβαίνουν λόγω του κανόνα του Hund και των διαμορφώσεων ηλεκτρονίων των ατόμων. Βασικά, ένα πλήρες υποεπίπεδο είναι πιο σταθερό από ένα που είναι μισογεμάτο, επομένως τα ουδέτερα άτομα κινούνται φυσικά σε αυτήν τη διαμόρφωση. Επίσης, έχει σημασία αν ένα υποεπίπεδο έχει ή όχι δύο ηλεκτρόνια με αντίθετες τιμές σπιν.
Για το βηρύλλιο, το πρώτο ηλεκτρόνιο δυναμικού ιονισμού προέρχεται από τα 2s τροχιακό, αν και ο ιονισμός του βορίου περιλαμβάνει 2p ηλεκτρόνιο. Τόσο για το άζωτο όσο και για το οξυγόνο, το ηλεκτρόνιο προέρχεται από το 2p τροχιακό, αλλά το σπιν είναι το ίδιο για όλα τα 2p ηλεκτρόνια αζώτου, ενώ υπάρχει ένα σύνολο ζευγαρωμένων ηλεκτρονίων σε ένα από τα 2p τροχιακά οξυγόνου.
Πρώτη, δεύτερη και τρίτη ενέργεια ιοντισμού
Η πρώτη ενέργεια ιονισμού είναι η ενέργεια που απαιτείται για την αφαίρεση του εξωτερικού ηλεκτρονίου σθένους, επομένως είναι η χαμηλότερη τιμή. Γενικά, η δεύτερη ενέργεια ιοντισμού είναι υψηλότερη από την πρώτη, ενώ η τρίτη είναι υψηλότερη από τη δεύτερη. Η αφαίρεση των επόμενων ηλεκτρονίων είναι πιο δύσκολη από την αφαίρεση του πρώτου, επειδή αυτά τα ηλεκτρόνια είναι πιο στενά συνδεδεμένα με τον πυρήνα και μπορεί να είναι πιο κοντά σε αυτόν.
Για παράδειγμα, εξετάστε το πρώτο (I1 ) και δεύτερο (I2 ) ενέργειες ιονισμού του magnesiu:
Mg (g) → Mg (g) + e I1 =738 kJ/mol
Mg (g) → Mg (g) + e I2 =1451 kJ/mol
Τάση συγγένειας ηλεκτρονίων
Η συγγένεια ηλεκτρονίων είναι ένα μέτρο του πόσο εύκολα ένα ουδέτερο άτομο μπορεί να αποκτήσει ένα ηλεκτρόνιο για να σχηματίσει ένα αρνητικό ιόν. Η συγγένεια των ηλεκτρονίων και η ενέργεια ιονισμού ακολουθούν την ίδια τάση στον περιοδικό πίνακα. Η συγγένεια ηλεκτρονίων αυξάνεται κατά τη διάρκεια μιας περιόδου και μειώνεται μετακινώντας προς τα κάτω μια ομάδα.
Αναφορές
- Cotton, F. Albert; Wilkinson, Geoffrey (1988). Προηγμένη Ανόργανη Χημεία (5η έκδ.). John Wiley. ISBN 0-471-84997-9.
- Lang, Peter F.; Smith, Barry C. (2003). «Ενέργειες ιονισμού των ατόμων και των ατομικών ιόντων». J. Chem. Εκπαιδεύω . 80 (8). doi:10.1021/ed080p938
- Miessler, Gary L.; Tarr, Donald A. (1999). Ανόργανη Χημεία (2η έκδ.). Prentice Hall. ISBN 0-13-841