Γεγονότα Oganesson – Στοιχείο 118

Το Oganesson είναι το στοιχείο 118 στον περιοδικό πίνακα, με το σύμβολο του στοιχείου Og. Είναι ραδιενεργό συνθετικό στοιχείο (δεν υπάρχει στη φύση). Το Oganesson έχει τον υψηλότερο ατομικό αριθμό από οποιοδήποτε στοιχείο του περιοδικού πίνακα. Ακολουθεί μια συλλογή γεγονότων oganesson, συμπεριλαμβανομένης της ανακάλυψης, των χρήσεων, των πηγών, των ατομικών δεδομένων και των φυσικών δεδομένων.
Βασικά στοιχεία Oganesson
Όνομα: Ογκανεσόν
Ατομικός αριθμός: 118
Σύμβολο στοιχείου: Og
Ομάδα: Ομάδα 18
Περίοδος: Περίοδος 7
Αποκλεισμός: μπλοκ p
Οικογένεια στοιχείων: Noble Gas (αν και πιθανότατα ένα στερεό με μεταλλική όψη σε θερμοκρασία και πίεση δωματίου)
Ατομική μάζα: [294]
Διαμόρφωση ηλεκτρονίου: [Rn] 5f 6d 7s 7p (προβλεπόμενο)
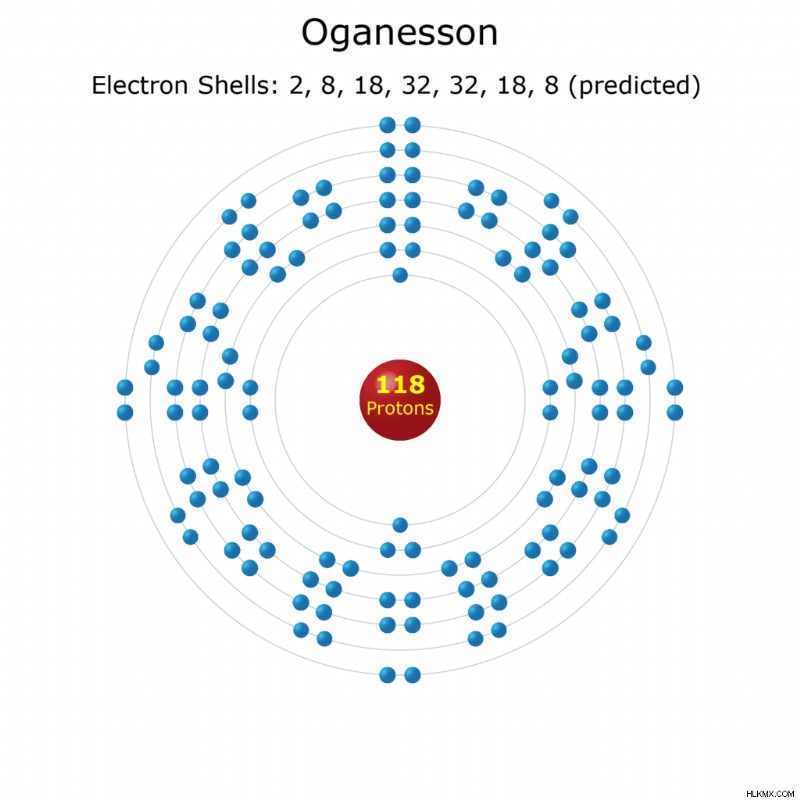
Ηλεκτρόνια ανά κέλυφος: 2, 8, 18, 32, 32, 18, 8 (προβλεπόμενο)
Ανακάλυψη: Joint Institute for Nuclear Research (Ρωσία) και Lawrence Livermore National Laboratory (ΗΠΑ) (2002)
Προέλευση ονόματος: Ονομάστηκε από τον Yuri Oganessian
Ιστορία της Ανακάλυψης
Το 1999, το εργαστήριο Lawrence Berkeley στην Καλιφόρνια ανακοίνωσε την ανακάλυψη του στοιχείου 118. Όμως, αποδείχθηκε ότι ο επικεφαλής επιστήμονας (Ninov) είχε κατασκευάσει δεδομένα, οπότε η ανακάλυψη ανακλήθηκε. Το 2002, Ρώσοι επιστήμονες στο Κοινό Ινστιτούτο Πυρηνικής Έρευνας στη Ντούμπνα της Ρωσίας, συνεργαζόμενοι με ερευνητές στο Εθνικό Εργαστήριο Lawrence Livermore (ΗΠΑ) ανακοίνωσαν την ανακάλυψη του στοιχείου 118. Η ρωσική ομάδα, με επικεφαλής τον Yuri Oganessian, βομβάρδισε το californium-249 με ιόντα ασβεστίου-48 για την παραγωγή τριών ατόμων oganesson.
Ονομασία στοιχείων
Πριν πάρει ένα επίσημο όνομα, το oganesson ήταν γνωστό ως eka-radon ή ununoctium (Uuo). Επειδή αυτά τα ονόματα ήταν δυσκίνητα, οι περισσότεροι το ονόμασαν απλώς «στοιχείο 118». Πριν ανακαλέσουν την ανακάλυψή τους το 2001, οι ερευνητές στο Εθνικό Εργαστήριο Lawrence Berkeley σκόπευαν να ονομάσουν το στοιχείο 118 ghiorsium (Gh) μετά του πυρηνικού επιστήμονα Albert Ghiorso. Το 2006, η IUPAC απένειμε τα δικαιώματα ονομασίας του στοιχείου στη ρωσική ομάδα από την Ντούμπνα. Θεώρησαν τα ονόματα flyorium (για τον ιδρυτή του εργαστηρίου Dubna, Georgy Flyorov) και το moskovium (για την περιφέρεια της Μόσχας, όπου βρίσκεται η Ντούμπνα. Οι παραλλαγές αυτών των ονομάτων τελικά αντιστοιχίστηκαν στο στοιχείο 114 (φλερόβιο) και στο στοιχείο 116 (moscovium). Σε μια τηλεδιάσκεψη στις 23 Μαρτίου 2016, οι επιστήμονες που συμμετείχαν στην ανακάλυψη των στοιχείων 115 , 117 και 118 ζήτησαν από τον Yuri Oganessian να αποχωρήσει από την κλήση και ψήφισαν ομόφωνα για την ονομασία του νέου στοιχείου oganesson προς τιμήν του. Ερευνητές στο Εθνικό Εργαστήριο Lawrence Livermore είπαν ότι είχαν επίσης σκοπό να προτείνουν το όνομα. Το όνομα του στοιχείου έγινε επίσημο στις 28 Νοεμβρίου 2016. Κατά τη στιγμή της ονομασίας, ο Yuri Oganessian ήταν πρωτοπόρος στον τομέα της έρευνας υπερβαρέων στοιχείων για περισσότερα από εξήντα χρόνια και είχε συμμετάσχει στη σύνθεση στοιχείων από το 107 έως το 118.
Ισότοπα
Όλα τα ισότοπα του oganesson είναι ραδιενεργά. Το ένα συντιθέμενο ισότοπο είναι το oganesson-294, με χρόνο ημιζωής 0,69 ms. Το Oganesson-295 πιστεύεται ότι έχει χρόνο ημιζωής 181 ms). Και τα δύο αυτά ισότοπα υφίστανται διάσπαση άλφα σε ήπαρ. Οι ερευνητές προβλέπουν ότι το oganesson-297 (σε περίπτωση που συντεθεί ποτέ) μπορεί να είναι πιο σταθερό λόγω της αναλογίας μεταξύ των πρωτονίων και των νετρονίων του.
Χρήσεις Oganesson
Προς το παρόν, η μόνη χρήση του oganesson είναι η έρευνα για τις ιδιότητες του στοιχείου και ίσως η εργασία για τη σύνθεση νέων υπερβαρέων στοιχείων.
Βιολογικός ρόλος και τοξικότητα
Επειδή είναι ένα συνθετικό στοιχείο, το oganesson δεν εξυπηρετεί κανένα βιολογικό ρόλο σε κανέναν οργανισμό. Η έκθεση στο στοιχείο θα ήταν τοξική λόγω της ραδιενέργειας του. Αλλά, δεδομένου ότι είναι ένας εκπομπός άλφα, μπορεί να είναι αρκετά ασφαλής ο χειρισμός του με γάντια. Επειδή είναι πιο δραστικό από άλλα ευγενή αέρια, το oganesson μπορεί να είναι δηλητηριώδες καθώς και ραδιενεργό.
Πηγές Oganesson
Το Oganesson δεν εμφανίζεται φυσικά. Η μόνη πηγή του στοιχείου είναι ένα εργαστήριο πυρηνικής έρευνας.
Φυσικά δεδομένα
Κατάσταση στο STP: στερεό (προβλεπόμενο)
Πυκνότητα: 4,9–5,1 g/cm (προβλεπόμενο)
Σημείο τήξης: 20 K(50 °C, 120 °F) (προβλεπόμενη)
Σημείο βρασμού: 350±30 K(80±30 °C, 170±50 °F) (προβλεπόμενη)
Κρίσιμο σημείο: 439 K, 6,8 MPa (προβλεπόμενη)
Heat of Fusion: 23,5 kJ/mol (προβλεπόμενο)
Θερμότητα εξάτμισης: 19,4 kJ/mol (προβλεπόμενο)
Ατομικά δεδομένα
Ομοιοπολική ακτίνα: 157 μ.μ. (προβλεπόμενη)
1 Ενέργεια Ιονισμού: 860,1 kJ/mol (προβλεπόμενο)
2 Ενέργεια Ιονισμού: 1560 kJ/mol (προβλεπόμενο)
Καταστάσεις οξείδωσης: -1, 0, +1, +2 , +4 , +6 (προβλεπόμενο)
Κρυσταλλική δομή: προσωποκεντρικό κυβικό (fcc) (προβλεπόμενο)
Ενδιαφέροντα γεγονότα Oganesson
- Το Oganesson είναι ένα από τα δύο μόνο στοιχεία που ονομάστηκαν από ένα άτομο που ζούσε τη στιγμή της ονομασίας. Το άλλο στοιχείο είναι το seaborgium. Τη στιγμή που γράφεται αυτό το άρθρο, το oganesson είναι το μόνο στοιχείο που ονομάστηκε για ένα άτομο που ζει ακόμα (Yuri Oganessian).
- Η θέση του στον περιοδικό πίνακα τοποθετεί το oganesson στην ομάδα των ευγενών αερίων, αλλά το στοιχείο σχεδόν σίγουρα δεν είναι αέριο και συμπεριφέρεται περισσότερο σαν μεταλλοειδές ή μέταλλο μετά τη μετάβαση παρά με οποιοδήποτε ευγενές αέριο. Αναμένεται να είναι ένα μεταλλικό στερεό. Ενώ η πιο κοινή κατάσταση οξείδωσης άλλων ευγενών αερίων είναι 0 (σχετικά μη αντιδρώσα), οι καταστάσεις οξείδωσης +4 και +6 είναι πιθανότατα οι προτιμώμενες καταστάσεις για το στοιχείο 118. Πολύ πιθανόν να σχηματίζει ενώσεις.
- Ο λόγος που το oganesson μπορεί να είναι στερεό είναι επειδή έχει τόσα πολλά ηλεκτρόνια που τα εξωτερικά περιφέρονται γύρω από τον ατομικό πυρήνα με σχετικιστικές ταχύτητες.
- Εάν το oganesson σχηματίσει ένα αέριο, θα είναι ένα από τα πιο πυκνά αέρια που έχουν γίνει ποτέ γνωστό, ακόμα κι αν είναι μονοατομικό. Είναι πιθανό το oganesson να σχηματίζει ένα διατομικό αέριο (Og2 ).
- Ο Oganesson πιθανότατα λειτουργεί ως ημιαγωγός. Τα ελαφρύτερα ευγενή αέρια είναι όλα μονωτικά.
- Το Oganesson μπορεί να σχηματίσει ιοντικό δεσμό με το φθόριο. Αντίθετα, άλλα ευγενή αέρια σχηματίζουν ομοιοπολικούς δεσμούς με το φθόριο (αν σχηματίζουν καθόλου δεσμούς).
- Λόγω του κόστους παραγωγής του και της ταχείας ραδιενεργής αποσύνθεσής του, όλες οι ιδιότητες του oganesson έχουν προβλεφθεί και όχι γνωστές πειραματικά.
Αναφορές
- Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). «Τρανσακτινίδια και τα μελλοντικά στοιχεία». Στο Morss? Edelstein, Norman M.; Fuger, Jean (επιμ.). Η χημεία των στοιχείων ακτινιδών και τρανσακτινιδίων (3η έκδ.). Ντόρντρεχτ, Ολλανδία:Springer Science+Business Media. ISBN 978-1-4020-3555-5.
- Mewes, Jan-Michael; Smits, Odile Rosette; Jerabek, Paul; Schwerdtfeger, Peter (2019). «Ο Ογκανεσόν είναι ημιαγωγός:Σχετικά με τη στενότητα του χάσματος ζώνης σχετικότητας στα βαρύτερα στερεά ευγενών αερίων». Angewandte Chemie . 58 (40):14260–14264. doi:10.1002/anie.201908327
- Nash, Clinton S. (2005). «Ατομικές και μοριακές ιδιότητες των στοιχείων 112, 114 και 118». Journal of Physical Chemistry A . 109 (15):3493–3500. doi:10.1021/jp050736o
- Ogannessian, Yu. Τσ.; Utyonkov, V. K.; Lobanov, Yu. V.; Abdullin, F. Sh.; Polyakov, Α. Ν.; Sagaidak, R. N.; Shirokovsky, I. V.; Tsyganov, Yu. ΜΙΚΡΟ.; et al. (2006). «Σύνθεση των ισοτόπων των στοιχείων 118 και 116 στις αντιδράσεις σύντηξης Cf και Cm+Ca». Φυσική ανασκόπηση Γ . 74 (4):044602. doi:10.1103/PhysRevC.74.044602




