Διαφορά μεταξύ ενέργειας δεσμού και ενέργειας διάστασης δεσμών
Κύρια διαφορά – Ενέργεια δεσμού έναντι ενέργειας διάσπασης δεσμού
Η ενέργεια του δεσμού και η ενέργεια διάστασης του δεσμού είναι όροι που συχνά φαίνονται μπερδεμένοι, καθώς και οι δύο σχετίζονται με τη διάσπαση ενός χημικού δεσμού μεταξύ δύο ατόμων. Οι έννοιες της ενέργειας δεσμού και της ενέργειας διάστασης δεσμών χρησιμοποιούνται συνήθως σε σχέση με ομοιοπολικούς δεσμούς. Αυτό συμβαίνει επειδή οι ομοιοπολικοί δεσμοί, σε αντίθεση με τους ιοντικούς δεσμούς, είναι άμεσοι δεσμοί μεταξύ ατόμων που σχηματίζονται λόγω της κοινής χρήσης ηλεκτρονίων. Η κύρια διαφορά μεταξύ της ενέργειας δεσμού και της ενέργειας διάστασης δεσμού είναι ότι η ενέργεια δεσμού αναφέρεται στη μέση ποσότητα ενέργειας που απαιτείται για τη διάσπαση όλων των δεσμών μεταξύ των ίδιων δύο τύπων ατόμων σε μια ένωση λαμβάνοντας υπόψη ότι ενέργεια διάστασης δεσμού είναι η ποσότητα ενέργειας που απαιτείται για τη διάσπαση ενός συγκεκριμένου δεσμού κατά την ομόλυση . Με άλλα λόγια, η ενέργεια του δεσμού είναι ο μέσος όρος των ενεργειών διάστασης δεσμών όλων των δεσμών που υπάρχουν μεταξύ των ίδιων τύπων ατόμων.
Βασικές περιοχές που καλύπτονται
1. Τι είναι η Ενέργεια Ομολόγων
– Ορισμός, Μονάδα Υπολογισμού, Παραδείγματα
2. Τι είναι η Ενέργεια Διάσπασης Ομολόγων
– Ορισμός, Παραδείγματα
3. Ποια είναι η διαφορά μεταξύ Ενέργειας Ομολογιών και Ενέργειας Διάσπασης Ομολόγων
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ενέργεια δεσμού, ενέργεια διάσπασης, χημικός δεσμός, άτομα, ομόλυση, ελεύθερες ρίζες

Τι είναι η ενέργεια ομολόγων
Η ενέργεια του δεσμού ορίζεται ως η μέση ποσότητα ενέργειας που απαιτείται για τη διάσπαση όλων των δεσμών που υπάρχουν μεταξύ των ίδιων δύο τύπων ατόμων σε μια ένωση. Κανονικά, τα άτομα συνδέονται μεταξύ τους για να μειώσουν την ενέργειά τους και να αποκτήσουν χαμηλότερο επίπεδο ενέργειας. Κάνοντας αυτό, τα άτομα γίνονται σταθερά. Όταν συμβεί ο δεσμός, απελευθερώνεται ένα ορισμένο ποσό ενέργειας. Αυτή η ενέργεια συχνά απελευθερώνεται ως θερμότητα. Επομένως, θα πρέπει να δοθεί κάποια ποσότητα ενέργειας για να σπάσει ο δεσμός.
Η μονάδα που υπολογίζεται η ενέργεια του δεσμού είναι kjmol. Η ενέργεια του δεσμού είναι διαφορετική για μόρια που έχουν έναν, δύο ή τρεις δεσμούς μεταξύ των ίδιων ατόμων. Για παράδειγμα, ο απλός δεσμός C-C απαιτεί ενέργεια δεσμού 347 kJmol για να σπάσει αυτόν τον δεσμό ενώ ο διπλός δεσμός C=C απαιτεί 614 kJmol. Αλλά η ποσότητα ενέργειας που απαιτείται για το C=C δεν είναι η διπλή τιμή από εκείνη του απλού δεσμού C-C. Ως εκ τούτου, οι ενέργειες των δεσμών διαφέρουν από τον έναν τύπο δεσμού στον άλλο.
Το καλύτερο παράδειγμα που μπορεί να ληφθεί υπόψη κατά την εξέταση της διαφοράς μεταξύ ενέργειας δεσμού και ενέργειας διάστασης δεσμού είναι το νερό (H2 Ο) μόριο.
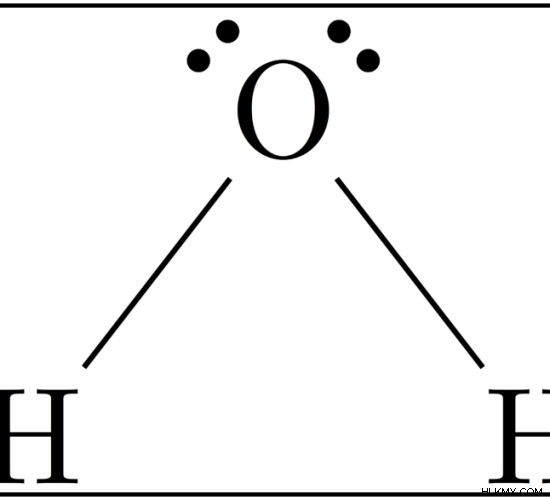
Εικόνα:Η δομή του H2O
Το H2 Το μόριο O αποτελείται από δύο δεσμούς O-H που συνδέονται ως H-O-H. Η ενέργεια του δεσμού για το H2 O είναι ο μέσος όρος των ενεργειών που απαιτούνται για τη διάσπαση των δύο δεσμών O-H του H2 Ω μόριο. Αν και οι δύο δεσμοί είναι ίδιοι, οι τιμές ενέργειας διαφέρουν ελαφρώς επειδή ο πρώτος δεσμός Ο-Η σπάει από τη δομή H-OH ενώ ο δεύτερος δεσμός σπάει ως Ο-Η. Δεδομένου ότι ένα άτομο οξυγόνου είναι πιο ηλεκτραρνητικό από ένα άτομο υδρογόνου, η διάσπαση του δεσμού Ο-Η από το μόριο του νερού επηρεάζεται από την παρουσία ή την απουσία ατόμων υδρογόνου και στις δύο πλευρές του ατόμου οξυγόνου. Επομένως, ο μέσος όρος λαμβάνεται ως ενέργεια δεσμού.
Τι είναι η ενέργεια διάσπασης δεσμών
Η ενέργεια διάστασης δεσμού μπορεί να οριστεί ως η ποσότητα ενέργειας που απαιτείται για τη διάσπαση ενός συγκεκριμένου δεσμού κατά την ομόλυση. Μετρά την αντοχή ενός χημικού δεσμού. Η ενέργεια διάστασης δεσμού σχετίζεται επίσης με ομοιοπολικούς δεσμούς. Δεδομένου ότι σχηματίζεται ένας ομοιοπολικός δεσμός όταν τα ηλεκτρόνια μοιράζονται μεταξύ των ατόμων, αυτά τα κοινά ηλεκτρόνια λαμβάνονται πίσω από τα άτομα στη διαδικασία διάστασης δεσμών. Ως εκ τούτου, οι ρίζες που σχηματίζονται είναι πολύ αντιδραστικές καθώς έχουν ασύζευκτα ηλεκτρόνια. Έτσι, εμφανίζεται μια διάσπαση ομόλυσης.
Αν το ίδιο παράδειγμα H2 Το O λαμβάνεται εδώ, η διάσταση δεσμού του H2 Το μόριο O θα σχηματίσει ρίζα ΟΗ και ρίζα Η με διάσπαση ομόλυσης όπως φαίνεται παρακάτω.
H2 O + ενέργεια → OH + H
Επομένως, αυτό που στην πραγματικότητα δίνεται από την ενέργεια διάστασης δεσμού είναι η ενέργεια που απαιτείται για τη διάσπαση ενός δεσμού –O-H. Έτσι, δίνεται η ίδια τιμή και για τους δύο δεσμούς –O-H.
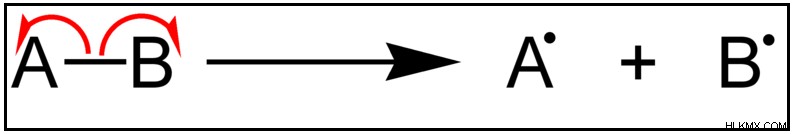
Εικόνα 2:Ομόλυση ενός χημικού δεσμού
Διαφορά μεταξύ ενέργειας δεσμού και ενέργειας διάστασης δεσμών
Ορισμός
Ενέργεια δεσμού: Η ενέργεια δεσμού αναφέρεται στη μέση ποσότητα ενέργειας που απαιτείται για τη διάσπαση όλων των δεσμών που υπάρχουν μεταξύ των ίδιων δύο τύπων ατόμων σε μια ένωση.
Ενέργεια διάσπασης δεσμών: Η ενέργεια διάστασης δεσμού είναι η ποσότητα ενέργειας που απαιτείται για τη διάσπαση ενός συγκεκριμένου δεσμού κατά την ομόλυση.
Προϊόν
Ενέργεια δεσμού:Β Η ενέργεια δίνει την ενέργεια που απαιτείται για το σχηματισμό των ατόμων που ήταν το αρχικό υλικό για το σχηματισμό δεσμών.
Ενέργεια διάσπασης δεσμών: Η ενέργεια διάστασης δεσμού δίνει την ενέργεια που απαιτείται για το σχηματισμό ελεύθερων ριζών από τα άτομα που σχημάτισαν τον συγκεκριμένο δεσμό.
Αξία για την ενέργεια
Ενέργεια ομολόγων: Η τιμή θα διαφέρει από τον ένα ομόλογο στον άλλο.
Ενέργεια διάσπασης δεσμών: Η τιμή θα είναι η ίδια για κάθε ομόλογο.
Συμπέρασμα
Τόσο η ενέργεια δεσμού όσο και η ενέργεια διάστασης δεσμού είναι σημαντικές για τον υπολογισμό της ενέργειας που απαιτείται για το σχηματισμό ή τη διάσπαση μιας συγκεκριμένης ένωσης. Αν και η ενέργεια του δεσμού και η ενέργεια διάστασης δεσμών φαίνονται ίδιες από την επισκόπηση, είναι δύο διακριτές μορφές. Η κύρια διαφορά μεταξύ ενέργειας δεσμού και ενέργειας διάστασης δεσμού είναι ότι η ενέργεια του δεσμού είναι η μέση ποσότητα ενέργειας που απαιτείται για τη διάσπαση όλων των δεσμών μεταξύ των ίδιων δύο τύπων ατόμων σε μια ένωση, ενώ η ενέργεια διάστασης δεσμού είναι η ποσότητα ενέργειας που απαιτείται για τη διάσπαση έναν ιδιαίτερο δεσμό στην ομόλυση. Με άλλα λόγια, η ενέργεια του δεσμού είναι ο μέσος όρος των ενεργειών διάστασης δεσμών όλων των δεσμών που υπάρχουν μεταξύ των ίδιων τύπων ατόμων.
Αναφορές:
1." Ενέργειες διάσπασης δεσμών οργανικών μορίων." LibreTexts Χημείας. Libretexts, 21 Ιουλίου 2016. Web. Διαθέσιμο εδώ. 13 Ιουνίου 2017.
Εικόνα Ευγενική προσφορά:
1. «H2O Lewis Structure PNG» Από Daviewales – Δική του εργασία (CC BY-SA 4.0) μέσω Commons Wikimedia
2. «Homolysis (Chemistry)» Από Jürgen Martens (Δημόσιος Τομέας) μέσω Commons Wikimedia




