Υποχλωριώδες (ClO-) – Δομή, Μοριακό Βάρος, Ιδιότητες, Χρήσεις
Το οξυγόνο, όταν αντιδρά με μέταλλα ή αμέταλλα, σχηματίζει γενικά οξείδια. Όπως και άλλα οξείδια, είναι για οξυοξέα ή οξυοξέα όταν το οξυγόνο αντιδρά με την οικογένεια αλογόνου. Εκτός από την οικογένεια αλογόνου, μπορεί να σχηματίσει οξυοξέα με βόριο, άζωτο, θείο και φώσφορο. Τα οξοξέα των αλογόνων υπάρχουν σε τέσσερις μορφές, δηλαδή, υποαλογονούχο οξύ (HOX), αλογονούχο οξύ (HOXO), αλικό οξύ (HOXO2 ), και υπεραλικό οξύ (HOXO3 ). Με αυτόν τον τρόπο, το οξοξύ του χλωρίου, που έχει κατάσταση οξείδωσης +1, είναι το υποχλωριώδες οξύ (HOCl). Στην ιοντική μορφή, υπάρχει ως υποχλωριώδες (ClO) ιόν. Όμως, γνωρίζετε ότι αυτό το υποχλωριώδες ιόν μπορεί να σχηματίσει διαφορετικούς κύριους υποχλωριώτες εκτός από το μονοβασικό οξύ; Ας δούμε αυτό το άρθρο για να μάθουμε περισσότερα σχετικά με το υποχλωριώδες οξύ και τα ιόντα και τις χρήσεις και τις ιδιότητές τους.
Τι είναι ένα ιόν υποχλωριώδους;
Υποχλωριώδες είναι τα άλατα που σχηματίζονται από τα οξοξέα των αλογόνων. Περιέχουν υποχλωριώδη ιόντα, δηλαδή ιόν ClO. Όταν ορισμένα κατιόντα συνδέονται με αυτά τα υποχλωριώδη ιόντα, σχηματίζουν διαφορετικά άλατα υποχλωριώδους οξέος. Ο πιο κοινός και μονοβασικός τύπος υποχλωριώδους οξέος είναι το HClO, γνωστό και ως υποχλωριώδες οξύ.
Υποχλωριώδες νάτριο (NaClO), υποχλωριώδες ασβέστιο [Ca(ClO)2 ] και χλωριούχο υποχλωριώδες ασβέστιο [CaCl(OCl)] ή (CaOCl2 ) είναι κάποιοι άλλοι σημαντικοί υποχλωριώτες. Το χλωροϋποχλωριώδες ασβέστιο είναι επίσης γνωστό ως σκόνη λεύκανσης. Ταυτόχρονα, το διάλυμα υποχλωριώδους νατρίου είναι επίσης γνωστό ως διάλυμα λεύκανσης, το οποίο χρησιμοποιείται για λεύκανση στην κλωστοϋφαντουργία.
Ιστορία του υποχλωριώδους άλατος
Το 1789, το υποχλωριώδες άλας παρήχθη για πρώτη φορά στο Javelle της Γαλλίας. Δημιουργήθηκε περνώντας αέριο χλώριο μέσω ενός διαλύματος ανθρακικού νατρίου. Το υγρό που προέκυψε ήταν ένα ασθενές διάλυμα υποχλωριώδους νατρίου, γνωστό ως Javelle water ή Eau de Javelle. Ωστόσο, δεν ήταν αποτελεσματικό, έτσι οι χημικοί αναζήτησαν άλλες μεθόδους παραγωγής. Τον 19ο αιώνα ο Ε.Σ. Ο Smith δημιούργησε μια μέθοδο παραγωγής υποχλωριώδους άλατος και την κατοχύρωσε με δίπλωμα ευρεσιτεχνίας. Σύμφωνα με τη διαδικασία του, η άλμη υδρολύεται για να παράγει αέριο χλώριο και καυστική σόδα. Μετά από αυτό, αναμειγνύονται για να σχηματίσουν υποχλωριώδες. Σήμερα, χρησιμοποιείται μια βελτιωμένη έκδοση αυτής της μεθόδου, γνωστή ως διαδικασία Hooker. Αυτή η διαδικασία είναι η μόνη μεγάλης κλίμακας βιομηχανική μέθοδος παραγωγής υποχλωριώδους νατρίου.
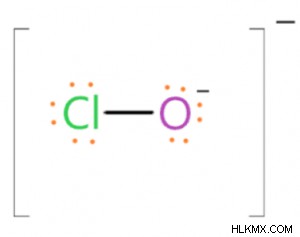
Δομή και Γεωμετρία του υποχλωριώδους ιόντος
Καθώς το υποχλωριώδες ιόν έχει ένα αρνητικό φορτίο, περιέχει ένα αρνητικά φορτισμένο άτομο οξυγόνου. Αυτό το άτομο Ο είναι μονοσθενές και συνδέεται με το άτομο Cl μέσω ενός απλού δεσμού, δηλαδή (Cl-O) 𝜎-δεσμού. Η δομή των ηλεκτρονίων αυτού του ιόντος δείχνει ότι υπακούει στον κανόνα της οκτάδας και σε αυτό, το άτομο Cl συνδέεται με το άτομο Ο με έναν δεσμό 𝜎 και έχει τρία μεμονωμένα ζεύγη πάνω του. Επομένως, καθώς το άτομο Cl-περιβάλλεται από έναν δεσμό 𝜎 και τρία μεμονωμένα ζεύγη, αυτό το άτομο είναι υβριδισμένο με sp3. Τα υβριδισμένα τροχιακά του ατόμου Cl-αλληλεπικαλύπτονται με τα υβριδισμένα τροχιακά του ιόντος Ο και σχηματίζουν (Cl-O) 𝜎-δεσμό. Λόγω της παρουσίας τριών μεμονωμένων ζευγών στο άτομο Cl, το ιόν ClO δεν έχει τετραεδρική γεωμετρία αλλά έχει γραμμικό σχήμα. Η απόσταση δεσμού Cl-O σε ιόν ClO- ισούται με 1,69Å και η ενέργεια του δεσμού Cl-O είναι 209 kJ/mol.
Παραγωγή υποχλωριωδών αλάτων
1. Αντίδραση με υδροξείδια αλκαλίων ή μετάλλων αλκαλικών γαιών:
Τα άλατα υποχλωριώδους οξέος παράγονται όταν αντιδρούν το χλώριο με υδροξείδια αλκαλίων ή μετάλλων αλκαλικών γαιών.
Cl2 + 2NaOH → NaCl + NaClO + H2 O
2Cl2 + 2Ca(OH)2 → CaCl2 + Ca(ClO)2 + 2H2 O
Αυτές οι αντιδράσεις πραγματοποιούνται κοντά σε θερμοκρασία δωματίου για την καταστολή του σχηματισμού χλωρικών.
2. Με ηλεκτροχημική διεργασία:
Σε αυτή τη διαδικασία, η άλμη ηλεκτρολύεται για να σχηματίσει Cl2 , το οποίο διασπάται στο νερό για να σχηματίσει υποχλωριώδες.
2Cl → Cl2 + 2e
Cl2 + H2 O ⇌ HClO + Cl + H
3. Αντίδραση με θειικά μέταλλα:
Όταν το υποχλωριώδες ασβέστιο αντιδρά με θειικά άλατα μετάλλων, παράγει υποχλωριώδες μέταλλο και θειικό ασβέστιο. Αυτή η αντίδραση πραγματοποιείται σε νερό.
Ca(ClO)2 + MSO4 → M(ClO)2 + CaSO4
Ιδιότητες του υποχλωριώδους ιόντος
Με βάση τα χαρακτηριστικά του, οι ιδιότητές του κατηγοριοποιούνται ως
1. Φυσικές ιδιότητες:
- Το όνομα IUPAC του ιόντος οξοξέος του χλωρίου είναι υποχλωριώδες.
- Ο τύπος του υποχλωριώδους οξέος είναι ClO.
- Το μοριακό βάρος του υποχλωριώδους είναι 51,449 g/mol.
- Είναι στερεό και αποσυντίθεται στους 40°C.
- Είναι διαλυτό στο νερό.
- Το υποχλωριώδες οξύ (HClO) είναι το συζυγές του οξύ.
- Είναι ένα οξείδιο του χλωρίου, ένα οξοανιόν χλωρίου και ένα μονοσθενές ανόργανο ανιόν.
- Είναι τοξικό όταν λαμβάνεται και εισπνέεται
2. Χημικές ιδιότητες:
- Στην οξίνιση, το υποχλωριώδες άλας δίνει υποχλωριώδες οξύ. Αυτή η αντίδραση βρίσκεται σε ισορροπία με το αέριο χλώριο.
2H + ClO + Cl ⇌ Cl2 + H2 O
- Κατά τη θέρμανση, το υποχλωριώδες διασπάται σε χλωριούχο, οξυγόνο και άλλα χλωρικά.
2ClO ➝ 2Cl + O2
3ClO ➝ 2Cl + ClO3
- Είναι εξαιρετικά ασταθές και μπορεί να υπάρχει μόνο στη μορφή διάλυσής του.
- Το υποχλωριώδες ασβέστιο έχει καλή σταθερότητα και παράγεται σε βιομηχανική κλίμακα.
- Δεν μπορεί να παρασκευαστεί καθαρό υποχλωριώδες μαγνήσιο.
- Στη θέρμανση, LiOCl και Ca(OCl)2 μπορεί να οδηγήσει σε επικίνδυνες θερμικές διαρροές και να γίνει εκρηκτικό.
- Ένα αραιό διάλυμα υποχλωριώδους νατρίου είναι σταθερό και χρησιμοποιείται ως οικιακό λευκαντικό.
- Το άνυδρο LiOCl είναι σταθερό σε θερμοκρασία δωματίου, ενώ το NaOCl είναι ασταθές πάνω από 0 °C.
- Το υποχλωριώδες οξύ από μόνο του είναι ασταθές σε απομόνωση επειδή αποσυντίθεται και παράγει χλώριο.
- Σε αντίδραση με την αμμωνία, το υποχλωριώδες άλας δίνει τα ακόλουθα προϊόντα:
NH3 + ClO → HO + NH2 Cl
NH2 Cl + ClO → HO + NHCl2
NHCl2 + ClO → HO + NCl3
Χρήσεις υποχλωριώδους άλατος
Οι σημαντικές χρήσεις του υποχλωριώδους οξέος είναι:
- Οξειδώνει τις πρωτοταγείς αλκοόλες σε καρβοξυλικά οξέα στην οργανική χημεία.
- Το υποχλωριώδες άλας χρησιμοποιείται ως παράγοντας χλωρίωσης. Μπορεί επίσης να χλωριώσει τους αρωματικούς υδρογονάνθρακες, οι οποίοι είναι πλούσιοι σε ηλεκτρόνια.
- Χρησιμοποιείται στην αντίδραση εποξείδωσης Jacobsen για να βοηθήσει στη μετατροπή του Mn (III) σε Mn (V).
- Είναι επίσης ισχυρός οξειδωτικός παράγοντας.
- Υποχλωριώδες νάτριο (NaOCl) και υποχλωριώδες ασβέστιο [Ca(OCl)2 ] χρησιμοποιούνται για τη λεύκανση των ρούχων.
- Χρησιμοποιείται ως μέσο αφαίρεσης λεκέδων.
- Το ιόν του λειτουργεί ως παράγοντας επεξεργασίας νερού.
- Το NaOCl είναι απολυμαντικό και αποσμητικό σε γαλακτοκομεία, παροχές νερού και απόρριψη λυμάτων.
- Οι υποχλωριώτες χρησιμοποιούνται για να ανοίξουν το χρώμα των μαλλιών.
- Το HOCl χρησιμοποιείται για τη λεύκανση χαρτοπολτού κ.λπ.
- Χρησιμοποιείται για τον καθαρισμό του νερού στα σπίτια.
- Η βασική χρήση των ιόντων υποχλωριώδους είναι για υλικά απολύμανσης και λεύκανσης.
- Είναι ένα από τα κύρια συστατικά διαφόρων απολυμαντικών.
- Βιομηχανικά, λειτουργεί ως λεύκανση, εξαλείφει τις άσχημες οσμές και καθαρίζει την επιφάνεια.
- Οι υποχλωριώτες χρησιμοποιούνται για τη μετατροπή των φαινολών σε χλωροφαινόλες.
- Το διάλυμα υποχλωριώδους νατρίου χρησιμοποιείται ως υγρό λευκαντικό στη βιομηχανία κλωστοϋφαντουργίας για τη λεύκανση χαρτοπολτού, λινού, βαμβακιού, ρεγιόν και γιούτας.
Κίνδυνοι για την υγεία που προκαλούνται από τον υποχλωρίτη
Αν και υπάρχουν πολλές χρήσεις του υποχλωριώδους οξέος, καθώς είναι πολύ αντιδραστικό και έχει διαβρωτικές ιδιότητες, προκαλεί πολλά προβλήματα υγείας. Μερικά από αυτά δίνονται παρακάτω:
- Ο υποχλωριώδες άλας γίνεται τοξικός όταν εισπνέεται και καταπίνεται.
- Ερεθίζει τα μάτια, τις μεμβράνες έκκρισης ούρων και το δέρμα.
- Η κατάποση μικρής ποσότητας οικιακής χλωρίνης μπορεί να προκαλέσει γαστρεντερικό ερεθισμό.
- Η κατάποση υψηλής συγκέντρωσης οικιακής χλωρίνης μπορεί να προκαλέσει σοβαρούς διαβρωτικούς τραυματισμούς στο λαιμό, διάτρηση, στο στόμα, στο στομάχι και στον οισοφάγο, αιμορραγία και τελικά θάνατο.
- Κοντά σε οργανικά υλικά, μπορεί να εκραγεί.
- Η επαφή με υψηλή συγκέντρωση υποχλωριωδών διαλυμάτων μπορεί να προκαλέσει φλεγμονή, πόνο στο κάψιμο και φουσκάλες στο δέρμα σας.
- Η έντονη και αντιδραστική φύση του μπορεί να ενισχύσει την καύση ή να προκαλέσει έκρηξη.
- Η μακροχρόνια έκθεση σε χαμηλά επίπεδα υποχλωριώδους μπορεί να προκαλέσει ερεθισμό του δέρματος.
Συμπέρασμα
Το υποχλωριώδες ιόν είναι πολύ ευαίσθητο στο περιβάλλον του και ως επί το πλείστον σχηματίζει σταθερές ενώσεις σε μορφή διαλύματος. Υπάρχει στις μορφές αλκαλικού και αλκαλικού μετάλλου της γαίας. Το υποχλωριώδες νάτριο, το υποχλωριώδες ασβέστιο, το χλωρουποχλωριώδες ασβέστιο και το υποχλωριώδες οξύ είναι οι γενικά απαντώμενες μορφές αλάτων υποχλωριώδους οξέος. Χρησιμοποιείται κυρίως ως απολυμαντικό για οικιακές εργασίες και ως λευκαντικό για διάφορους σκοπούς. Χρησιμοποιείται με πολλούς τρόπους και σε διαφορετικές βιομηχανίες. Ωστόσο, προκαλεί επίσης πολλούς κινδύνους για την υγεία, όπως ερεθισμό των ματιών, κάψιμο του δέρματος, φουσκάλες, τοξικότητα και μπορεί να οδηγήσει σε θάνατο. Επειδή το υποχλωριώδες ιόν είναι εξαιρετικά αντιδραστικό, είναι απαραίτητος ο χειρισμός και η αποθήκευση του με μεγάλη προσοχή και μόνο σε γυάλινα, πήλινα ή πλαστικά δοχεία από πολυβινυλοχλωρίδιο. Επίσης, τα προϊόντα οικιακής χρήσης που περιέχουν υποχλωριώδες ασβέστιο ή νάτριο θα πρέπει να φυλάσσονται σε ασφαλή μέρη, μακριά από παιδιά.
Συχνές ερωτήσεις
1. Το υποχλωριώδες ιόν είναι πολικό ή μη πολικό;
Α. Το ClOion είναι ένα μη πολικό μόριο επειδή περιέχει δύο άτομα (δηλαδή, χλώριο και οξυγόνο) διατεταγμένα συμμετρικά. Εξαιτίας αυτού, οι διπολικές ροπές που δημιουργούνται και στις δύο πλευρές αλληλοεξουδετερώνονται, καθιστώντας το μη πολικό μόριο.
2. Γιατί είναι απαραίτητη η χρήση γυαλιού, πλαστικού PVC ή άλλων ειδικών δοχείων για την αποθήκευση υποχλωριώδων;
Α. Οι υποχλωριώτες είναι εξαιρετικά αντιδραστικοί και ως εκ τούτου πολύ ευαίσθητοι σε ιχνοστοιχεία όπως το νικέλιο, ο χαλκός, το χρώμιο, ο σίδηρος, το μαγγάνιο και το κοβάλτιο. Όχι μόνο προς τα ιχνοστοιχεία, αλλά το υποχλωριώδες άλας είναι επίσης τόσο αντιδραστικό που προσβάλλει πολλά υλικά όπως το καουτσούκ, ορισμένα πλαστικά και τα περισσότερα είδη υφασμάτων με βίαιο τρόπο. Ως εκ τούτου, αποθηκεύεται σε ειδικό τύπο δοχείου με προσοχή.
3. Το υποχλωριώδες ιόν είναι οξύ ή βάση;
Α. Το υποχλωριώδες ιόν (ClO) είναι μια βάση στη φύση γιατί δέχεται ένα πρωτόνιο (δηλαδή Η) όταν διαλυθεί στο νερό. Ως αποτέλεσμα, σχηματίζει υποχλωριώδες οξύ (HClO). Και ξέρετε τα είδη που δέχονται το πρωτόνιο σε ένα υδατικό διάλυμα είναι βασικά. ClO + H2 O → HClO + OH Το υποχλωριώδες οξύ (HClO) είναι ένα συζευγμένο οξύ υποχλωριώδους ιόντος (ClO).




