Chalcogens- Στον περιοδικό πίνακα
Βασικές έννοιες
Σε αυτό το σεμινάριο θα μάθετε για την οικογένεια Chalcogens στον περιοδικό πίνακα, καθώς και για τα μοναδικά χαρακτηριστικά τους.
Θέματα που καλύπτονται σε άλλα άρθρα
- Τροχιακά ηλεκτρονίων και σχήματα τροχιών
- Θεωρία δεσμού σθένους
- Τι είναι η Εντροπία
- Ενέργεια ιονισμού
- Τάσεις ατομικής ακτίνας
Χαλκογόνα στον περιοδικό πίνακα
Τα χαλκογόνα είναι στοιχεία που ανήκουν στην ομάδα 16 του περιοδικού πίνακα. Υπάρχουν πέντε στοιχεία που μπορούν να ταξινομηθούν ως χαλκογόνα:οξυγόνο, θείο, σελήνιο, τελλούριο και πολώνιο. Μερικοί επιστήμονες θεωρούν ότι το livermorium είναι επίσης μέλος των χαλκογόνων. Μερικές φορές είναι σύνηθες το οξυγόνο να αποκλείεται από την οικογένεια των χαλκογόνων. Αυτό συμβαίνει επειδή τα χαρακτηριστικά του οξυγόνου διαφέρουν λίγο μεταξύ των άλλων στοιχείων της οικογένειας.
Κάθε στοιχείο της οικογένειας των χαλκογόνων έχει 6 ηλεκτρόνια στο κέλυφος σθένους. Αυτή η οικογένεια στοιχείων πήρε το όνομά της από την ελληνική λέξη «χάλκος», που σημαίνει μεταλλεύματος, καθώς καθένα από αυτά τα στοιχεία βρίσκεται στα μεταλλεύματα χαλκού και στα σουλφίδια και τα οξείδια στον φλοιό της Γης. Τα περισσότερα από τα χαλκογόνα έχουν περισσότερα από ένα αλλότροπα, την ύπαρξη ενός χημικού στοιχείου σε δύο ή περισσότερες μορφές. Για παράδειγμα, το θείο έχει πάνω από 20 αλλότροπα και το οξυγόνο είναι γνωστό ότι έχει περίπου 9.
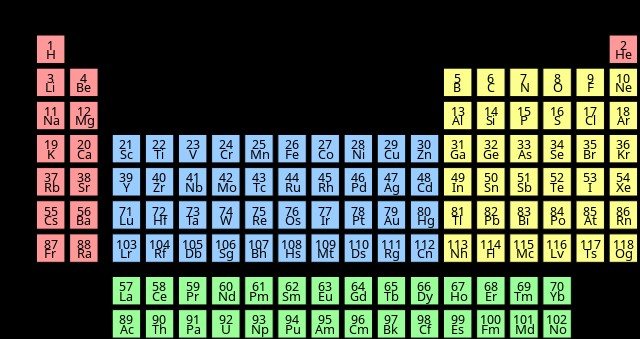
Διαμόρφωση ηλεκτρονίων για Chalcogens
Γενικά η διαμόρφωση ηλεκτρονίων για τα χαλκογόνα είναι nsnp. Η διαμόρφωση ηλεκτρονίων για το livermorium, η οποία δεν εμφανίζεται στο γράφημα, είναι [Rn]5f6d7s7p.
| Χαλκογόνο | Διαμόρφωση ηλεκτρονίων |
| Πολώνιο (Po) | [Xe]4f5d6s6p |
| Θείο (S) | [Ne]3s3p |
| Σελήνιο (Se) | [Ar]3d4s4p |
| Τελλούριο (Te) | [Kr]4d5s5p |
| Οξυγόνο (O) | [He]2s2p |
Ατομική και ιοντική ακτίνα των στοιχείων της ομάδας 16
Τόσο η ατομική όσο και η ιοντική ακτίνα των στοιχείων της οικογένειας των χαλκογόνων είναι μικρότερες από εκείνες της ομάδας που προηγείται τους, ομάδα 15. Αυτό οφείλεται στο αυξημένο ενεργό πυρηνικό φορτίο, τη μεγαλύτερη έλξη των ηλεκτρονίων προς τον πυρήνα του ατόμου ακτίνα μείωσης Μέγεθος. Όπως ήταν αναμενόμενο, με βάση τις τάσεις της ατομικής και ιοντικής ακτίνας στον περιοδικό πίνακα, η ακτίνα των χαλκογόνων αυξάνεται όταν κινούμαστε κάτω από μια ομάδα. Άρα, το χαλκογόνο με τη μικρότερη ατομική ακτίνα και ιοντική ακτίνα είναι οξυγόνο. Το χαλκογόνο με τη μεγαλύτερη ατομική και ιοντική ακτίνα είναι το πολώνιο.
Σημεία τήξης και βρασμού
Δεδομένου ότι υπάρχει μια αύξηση στο ατομικό μέγεθος και τις μάζες όταν μετακινούμαστε προς τα κάτω σε μια ομάδα στον περιοδικό πίνακα, τα σημεία τήξης και βρασμού αυτών των στοιχείων θα έχουν άμεση συσχέτιση. Αυτό συμβαίνει επειδή καθώς κινούμαστε κάτω από μια ομάδα το μέγεθος των δυνάμεων van der Waals αυξάνεται επίσης. Έτσι, είναι γνωστό ότι το οξυγόνο έχει το χαμηλότερο σημείο τήξης και βρασμού.
Ενέργειες ιονισμού
Όταν η ακτίνα ή το μέγεθος ενός ατόμου αυξάνεται, η ενέργεια ιονισμού μειώνεται. Αυτό συμβαίνει επειδή όσο μεγαλύτερη είναι η απόσταση των ηλεκτρονίων στο κέλυφος σθένους από τον πυρήνα τόσο λιγότερες δυνάμεις έλξης έχει ο πυρήνας σε αυτά τα ηλεκτρόνια. Έτσι, στοιχεία μικρότερου μεγέθους θα έχουν συχνά υψηλότερες ενέργειες ιονισμού από τα στοιχεία με μεγαλύτερο μέγεθος. Εξαιτίας αυτού, η ενέργεια ιονισμού των χαλκογόνων μειώνεται καθώς κινούμαστε προς τα κάτω στην ομάδα. Το οξυγόνο είναι γνωστό ότι έχει την υψηλότερη ενέργεια ιονισμού μεταξύ της οικογένειας. Μπορεί επίσης να είναι σημαντικό να σημειωθεί ότι καθώς κινούμαστε σε μια περίοδο στον περιοδικό πίνακα η ενέργεια ιονισμού αυξάνεται. Επομένως, το οξυγόνο έχει υψηλότερη ενέργεια ιονισμού από ένα στοιχείο όπως το λίθιο.
Αντιδράσεις μεταξύ των στοιχείων της ομάδας 16
Όταν τα χαλκογόνα αντιδρούν με το διυδρογόνο (H2 ), συνήθως σχηματίζουν υδρίδια με τον τύπο H2 X. Το X υποδηλώνει οποιοδήποτε από τα χαλκογόνα:οξυγόνο, θείο, σελήνιο, τελλούριο ή πολώνιο.
Χ (χαλκογόνο) + Η2 (διυδρογόνο) → H2 Χ (υδρίδιο του χαλκογόνου)
Χαρακτηριστικά της Ομάδας 16
Οξυγόνο
- Διαμόρφωση :1s2s2p
- Το οξυγόνο διέρχεται από τη σκουριά μέσω της οξείδωσης και είναι γνωστό ότι αντιδρά με άλλα άτομα.
- Το οξυγόνο είναι το λιγότερο πυκνό από όλα τα χαλκογόνα με πυκνότητα 0,00143 g/cm.
- Σε θερμοκρασία δωματίου το οξυγόνο βρίσκεται σε αέρια κατάσταση και είναι άχρωμο, άοσμο και άγευστο.
- Φτάνει στο σημείο βρασμού του γύρω στους -297,31 βαθμούς F.
Πολώνιο
- Το πολώνιο είναι το μεγαλύτερο από όλα τα χαλκογόνα με 2, 8, 18, 32, 18 και 6 ηλεκτρόνια στα κελύφη.
- Η διαμόρφωσή του είναι 1s2sp3spd4spdf5spd6sp.
- Το πολώνιο έχει την υψηλότερη πυκνότητα, με πυκνότητα 9,196 g/cm.
- Το πολώνιο αποτελεί εξαίρεση στον κανόνα της αύξησης του σημείου βρασμού με το ατομικό βάρος, καθώς το σημείο βρασμού του είναι χαμηλότερο από το τελλούριο στους 1764 βαθμούς F.
- 33 διαφορετικά ισότοπα αυτού του στοιχείου μπορούν να βρεθούν στη Γη.
Τελλούριο
- Η διαμόρφωση ηλεκτρονίων για το τελλούριο είναι 1s2sp3spd4spd5sp.
- Το Τελλούριο έχει το υψηλότερο σημείο βρασμού από όλα τα χαλκογόνα στους 1810 βαθμούς F.
- Βρίσκεται φυσικά ως μεταλλοειδές αργύρου όταν είναι στην κρυσταλλική του μορφή.
Σελήνιο
- Η διαμόρφωση ηλεκτρονίων του σεληνίου είναι 1s2sp3spd4sp.
- Παρόλο που το σελήνιο είναι μη μέταλλο, μπορεί να μεταφέρει ηλεκτρισμό.
- Το σημείο βρασμού του σεληνίου είναι επίσης πολύ υψηλό στους 1265 βαθμούς F.
- Βρίσκεται φυσικά ως κοκκινωπή σκόνη, αλλά όταν υποβάλλεται σε επεξεργασία γίνεται μαύρο.
- Το σελήνιο είναι φωτοαγώγιμο, καθιστώντας το ηλεκτρικά φορτισμένο όταν εκτίθεται στο φως.
Θείο
- Η διαμόρφωση ηλεκτρονίων του θείου είναι 1s2sp3sp.
- Το θείο έχει ένα μεγάλο εύρος καταστάσεων οξείδωσης που κυμαίνονται από -2 έως +6.
- Αυτό το στοιχείο βρίσκεται σε ίχνη στον φλοιό της Γης και στο ανθρώπινο σώμα.
- Το θείο είναι ένα κίτρινο στερεό και παράγει μια σάπια μυρωδιά όταν καίγεται.