Τι είναι το τεστ για ιόντα αμμωνίου
Τι είναι η δοκιμή για ιόντα αμμωνίου είναι μια ενδιαφέρουσα ερώτηση στον τομέα της χημείας. Μπορεί να απαντηθεί με τον ακόλουθο τρόπο. Υπάρχουν διάφορες ποιοτικές μέθοδοι αναγνώρισης ιόντων αμμωνίου. Η πιο εύκολη μέθοδος είναι η αντίδραση με υδροξείδιο του νατρίου για την έκλυση αερίου αμμωνίας. Υπάρχουν διάφορες μέθοδοι για την αναγνώριση αερίου αμμωνίας. Αυτό το άρθρο εξηγεί λεπτομερώς αυτές τις μεθόδους. Η αμμωνία είναι ένας παράγοντας σχηματισμού συμπλόκου με μεταλλικά ιόντα. σύμπλοκα μετάλλων δίνουν ένα χαρακτηριστικό χρωματισμό στο μίγμα της αντίδρασης. Αυτές οι αντιδράσεις μπορούν να χρησιμοποιηθούν για την αναγνώριση ιόντων αμμωνίου. Σε ορισμένες περιπτώσεις, τα ιόντα αμμωνίου σχηματίζουν ιζήματα με ορισμένα από τα χημικά αντιδραστήρια. Τα ιόντα αμμωνίου μπορούν να δράσουν ως οξειδωτικός και αναγωγικός παράγοντας. Ως εκ τούτου, εμπλέκεται σε τόσες πολλές χημικές αντιδράσεις. Μερικές από αυτές τις αντιδράσεις περιελάμβαναν σχηματισμό ιζημάτων, αλλαγές στο χρώμα στην αντίδραση και έκλυση αερίων. Χρησιμοποιούνται ως δοκιμές για την αναγνώριση ιόντων αμμωνίου. Επιπλέον, υπάρχουν ορισμένες ευαίσθητες μέθοδοι για την αναγνώριση ιόντων αμμωνίου. Αυτές οι μέθοδοι επιτρέπουν τον εντοπισμό ιόντων αμμωνίου ακόμη και αν υπάρχουν σε ίχνη.
Δοκιμή για ιόντα αμμωνίου
1. Διάλυμα υδροξειδίου του νατρίου
Η αέρια αμμωνία εκλύεται κατά τη θέρμανση. Υπάρχουν λίγοι τρόποι αναγνώρισης του εξελισσόμενου αερίου.
NH4+ + OH- —> NH3 (g) + H2O
• Από τη χαρακτηριστική του οσμή:Μυρίζοντας προσεκτικά τη μυρωδιά του ατμού, αφαιρώντας τον δοκιμαστικό σωλήνα από τη φλόγα.
• Με μια γυάλινη ράβδο βρεγμένη με πυκνό υδροχλωρικό οξύ συγκρατείται στον ατμό σχηματίζοντας τους λευκούς ατμούς του χλωριούχου αμμωνίου.
NH3(g)+ HCl —> NH4Cl(g)
(Λευκός καπνός)
• Με την ικανότητά του να μετατρέπει το διηθητικό χαρτί που έχει υγρανθεί με νιτρικό υδράργυρο(I) σε μαύρο. Σε αυτή τη δοκιμή, σχηματίζεται ένα μείγμα ιζημάτων υδραργύρου(II)αμιδονιτρικού (λευκού) και υδραργύρου (μαύρου).
2NH3+ Hg2 + ΟΧΙ3 —> Hg(NH3)NO3(s) + Hg + NH4
(Λευκό) (Μαύρο)
• Με την ικανότητά του να αλλάζει το υγρό κόκκινο χαρτί λακκούβας σε μπλε ή κουρκουμά χαρτί σε καφέ.
• Με διηθητικό χαρτί βρεγμένο με διάλυμα χλωριούχου μαγγανίου (II) και υπεροξειδίου του υδρογόνου δίνει ένα καφέ χρώμα. Αυτό οφείλεται στην οξείδωση του μαγγανίου(II) σε οξείδιο του μαγγανίου(IV) από το αλκαλικό διάλυμα που σχηματίζεται.
2NH3 +Mn+ H2 O2 + H2 O —> 2NH+ MnO(OH)2(s)
(σειρά B)
2. Εξανιτριτοκοβαλτικό νάτριο (III)
Όταν ένα διάλυμα αμμωνίου υποβάλλεται σε επεξεργασία με εξανιτροκοβαλτικό νάτριο (III), (Na3[Co(NO2)6], δίνει ένα κίτρινο ίζημα εξανιτροκοβαλτικού αμμωνίου. Αυτό είναι παρόμοιο με αυτό παράγεται με ιόντα καλίου.
3NH + [Co(NO2)6] —> (NH4)3[Co(NO2)6] (s)
(Κίτρινο)
3. Διάλυμα υπερχλωρικού οξέος ή υπερχλωρικού νατρίου
Δεν σχηματίζεται ίζημα με ιόντα αμμωνίου. Αυτή η δοκιμή είναι μια διάκριση από τα ιόντα καλίου.
4. Αντιδραστήριο Nessler:αλκαλικό διάλυμα τετραϊωδομυδρουρικού καλίου (II)
Παρουσία ιόντων αμμωνίου με το αντιδραστήριο Nessler, σχηματίζει ένα ίζημα αμιδοϊωδιούχου υδραργύρου (II). Το χρώμα του ιζήματος ποικίλλει από κίτρινο έως καφέ, ανάλογα με την ποσότητα των ιόντων αμμωνίου.
NH + 2[HgI4]+ 4OH —> HgO. Hg(NH2 I (s) +7I +3H2 Ον
(Κίτρινο ή καφέ)
Αυτή η δοκιμή μπορεί να χρησιμοποιηθεί για τον εντοπισμό ιχνών αμμωνίας που υπάρχουν στο πόσιμο νερό.
**Σημείωση:Όλα τα μέταλλα εκτός από το νάτριο ή το κάλιο πρέπει να απουσιάζουν για να πραγματοποιηθεί αυτή η δοκιμή.
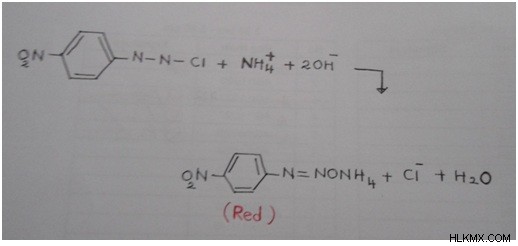
5. Αντιδραστήριο P-Νιτροβενζόλιο-χλωριούχο διαζώνιο
Αυτό το αντιδραστήριο δίνει κόκκινο χρώμα με άλας αμμωνίου παρουσία διαλύματος υδροξειδίου του νατρίου.
6. Εξαχλωροπλατινικό(IV) οξύ:H2 [PtCl6 ]
Με αυτό το αντιδραστήριο σχηματίζεται ένα κίτρινο ίζημα εξαχλωροπλατινικού αμμωνίου(IV).
2NH + [PtCl6 ] —> (NH4 )2 [PtCl6 ](s)
(Κίτρινο)
Τα χαρακτηριστικά αυτού του ιζήματος είναι παρόμοια με αυτό που σχηματίζεται με το άλας καλίου. Ωστόσο, μπορεί να διακριθεί με αποσύνθεση με υδροξείδιο του νατρίου, με την έκλυση αερίου αμμωνίας κατά τη θέρμανση.
7. Δοκιμή ταννικού οξέος – νιτρικού αργύρου
Η χημεία πίσω από αυτήν τη δοκιμή είναι η αναγωγή του ταννικού οξέος στο σύμπλοκο αμίνης αργύρου [Ag(NH3 )2 ], για να δώσει μαύρο ασήμι. Εδώ ο άργυρος καθιζάνει παρουσία αμμωνίας, αλλά όχι από ένα ελαφρώς όξινο διάλυμα νιτρικού αργύρου.
Διαδικασία:Αναμείξτε δύο σταγόνες διαλύματος ταννικού οξέος 5% με δύο σταγόνες διαλύματος νιτρικού αργύρου 20%. Τοποθετήστε το μείγμα πάνω σε χαρτί αντίδρασης σταγόνας (ή σε λίγο βαμβάκι). Κρατήστε το χαρτί στον ατμό που παράγεται από τη θέρμανση ενός άλατος αμμωνίου με διάλυμα υδροξειδίου του νατρίου.
Ένας μαύρος λεκές που σχηματίζεται στο χαρτί (ή στο βαμβάκι).
**Σημείωση:Αυτή η δοκιμή είναι ευαίσθητη.
Τι είναι η δοκιμή για ιόντα αμμωνίου – Περίληψη
Όλα τα άλατα αμμωνίου αποσυντίθενται σε αμμωνία κατά τη θέρμανση. Το εξελιγμένο αέριο της αμμωνίας έχει μια χαρακτηριστική μυρωδιά, μετατρέπει την υγρή κόκκινη λακκούβα μπλε και μετατρέπει το γενικό χαρτί λακκούβας σε μπλε. Αυτές οι ποιοτικές παρατηρήσεις μπορούν να χρησιμοποιηθούν ως μέθοδος δοκιμής ταυτοποίησης για την αμμωνία. Τα άλατα αμμωνίου σχηματίζουν έγχρωμα μεταλλικά σύμπλοκα με μερικά από τα στοιχεία d-block. Αυτές οι χημικές αντιδράσεις χρησιμοποιούνται για την αναγνώριση ιόντων αμμωνίου σε ένα άγνωστο μείγμα. Τα ιόντα αμμωνίου εμπλέκονται σε πολλές αντιδράσεις οξειδοαναγωγής, συμπεριλαμβανομένου του σχηματισμού ιζημάτων και των αλλαγών στο χρώμα. Αντιδράσεις που περιλαμβάνουν οπτικές παρατηρήσεις χρησιμοποιούνται ως μέθοδοι δοκιμής για τον εντοπισμό ιόντων αμμωνίου.




