Ονομασία ιοντικών ενώσεων
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μάθετε για την ονοματολογία και την ονομασία ιοντικών ενώσεων . Θα αντλήσουμε ονόματα από τους χημικούς τύπους δυαδικών και πολυατομικών ιοντικών ενώσεων.
Θέματα που καλύπτονται σε άλλα άρθρα
- Ονομασία οργανικών ενώσεων IUPAC
- Ονομασία ομοιοπολικών ενώσεων
- Μόριο έναντι ένωσης
- Ονομασία αλκανίων
- Κοινά πολυατομικά ιόντα
Λεξιλόγιο
- Σύνθεση: ουσία που περιέχει μόρια που αποτελούνται από άτομα δύο ή περισσότερων χημικών στοιχείων (μπορεί να είναι ιοντικά ή ομοιοπολικά)
- Ιόν: άτομο ή ομάδα ατόμων που διαθέτουν ηλεκτρικό φορτίο
- Χρέωση: βρέθηκε αφαιρώντας (πρωτόνια-ηλεκτρόνια). αλλαγές κατά τον ιοντικό δεσμό λόγω μεταφοράς ηλεκτρονίων
- Κατιόν:θετικά φορτισμένο ιόν. σχηματίζεται όταν το ουδέτερο άτομο χάνει ηλεκτρόνια
- Ανιόν:θετικά φορτισμένο ιόν. σχηματίζεται όταν το ουδέτερο άτομο χάνει ηλεκτρόνια
- Ιωνικός δεσμός: ενώσεις που σχηματίζονται από τη μεταφορά ηλεκτρονίων μεταξύ κατιόντων και ανιόντων
- Ο συμμετέχων κατιόν είναι σχεδόν πάντα μέταλλο
- Ο συμμετέχων σε ανιόν είναι σχεδόν πάντα μη μέταλλο
- Δυαδική ιοντική ένωση: έχει δύο συστατικά, καθένα από τα οποία αποτελείται από άτομα από ένα μόνο στοιχείο
- Μονατομικό:άτομα ενός μόνο στοιχείου
- Πολυατομική ιοντική ένωση: κάθε συστατικό περιέχει άτομα από περισσότερα από ένα στοιχεία
- Μπορεί να σταθεί μεμονωμένα ως πολυατομικό κατιόν και ανιόν
- Λειτουργεί ως ενιαία, φορτισμένη μονάδα
- Μπορούν να συνδυαστούν για να σχηματίσουν ενώσεις
- Μπορεί να σταθεί μεμονωμένα ως πολυατομικό κατιόν και ανιόν
Εισαγωγή
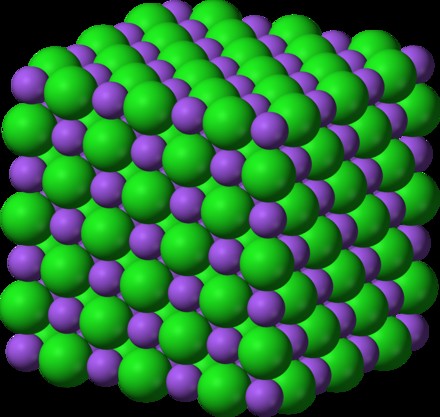
Τι είναι οι ιοντικές ενώσεις; Οι ιοντικές ενώσεις σχηματίζονται όταν άτομα ή μόρια προσελκύουν άλλα με αντίθετα φορτία. Αυτή η αλληλεπίδραση συνήθως συμβαίνει μεταξύ ενός μετάλλου, που φέρει θετικό φορτίο, και ενός μη μετάλλου, που φέρει αρνητικό φορτίο. Η ηλεκτροστατική έλξη μεταξύ των συμμετεχόντων διευκολύνει τη μεταφορά ηλεκτρονίων μεταξύ τους.
Αυτές οι ενώσεις διατάσσονται σε μια δομή «πλέγματος». Το ιοντικό πλέγμα διασφαλίζει ότι κάθε ιόν σχηματίζει κανονικά σχέδια με τα αντίθετα φορτισμένα ιόντα να το περιβάλλουν. Για να ονομάσετε αυτές τις ενώσεις, πρέπει να λάβετε υπόψη τα ιόντα συστατικά τους.
Δυαδικές ιοντικές ενώσεις
Αρχικά, θα μάθουμε πώς να ονομάζουμε δυαδικές ιοντικές ενώσεις. Οι δύο συμμετέχοντες μπορεί να είναι μονατομικοί. Ή μπορεί να αποτελούνται από πολλαπλά άτομα, αντίστοιχα. Είτε έτσι είτε αλλιώς, θα εφαρμοστεί η διαδικασία δυαδικής ιοντικής ονομασίας.
Οι ενώσεις μετάλλων με αλογονίδια ή οξυγόνο είναι συνήθως ιονικά στερεά , τα οποία έχουν ένα πλέγμα που συνδέει τα κατιόντα και τα ανιόντα, που συγκρατούνται μαζί με ηλεκτροστατικές δυνάμεις.
Ονομάστε πρώτα το κατιόν
Το κατιόν, ή το θετικά φορτισμένο σωματίδιο, ξεκινά πάντα το όνομα της ένωσης. Ωστόσο, οι συγκεκριμένες συμβάσεις ονομασίας θα διαφέρουν μεταξύ των στοιχειακών ομάδων.
Ομάδες 1 και 2
Τα στοιχεία που βρίσκονται στην πρώτη και τη δεύτερη ομάδα στον περιοδικό πίνακα σχηματίζουν πάντα ιόντα με φορτίο ίσο με τον αριθμό της ομάδας τους. Αυτή η σταθερή τάση σημαίνει ότι οι ενώσεις που περιέχουν ένα από αυτά τα στοιχεία θα ξεκινούν απλώς με το όνομά του.
Για παράδειγμα, το ιόν καλίου από την πρώτη ομάδα φέρει πάντα φορτίο 1+. Το όνομα της ένωσης του θα ξεκινούσε έτσι με «κάλιο». Το ίδιο ισχύει και για την δεύτερη ομάδα. Για να ονομάσετε μια ένωση που περιέχει ένα κατιόν μαγνησίου, το οποίο έχει φορτίο 2+, θα ξεκινούσατε γράφοντας «μαγνήσιο».
Μερικά μέταλλα εκτός αυτών των δύο ομάδων φέρουν επίσης σχεδόν πάντα το ίδιο φορτίο. Το αλουμίνιο, ο ψευδάργυρος, το σκάνδιο και το ασήμι θα έχουν συνήθως φορτίο +3, +2, +3 και +1 αντίστοιχα και επομένως δεν πρέπει να χρησιμοποιείτε λατινικούς αριθμούς όπως τα άλλα μέταλλα.
Δεύτερη ονομασία του ανιόντος
Αφού γράψετε το όνομα του κατιόντος, μπορείτε να τοποθετήσετε το όνομα του μονατομικού ανιόντος ακολουθούμενο από το επίθημα "ide". Για παράδειγμα, ο χημικός τύπος KCl παράγει το όνομα "χλωριούχο ασβέστιο".
Ονομασία μεταβατικών κατιόντων μετάλλων
Αλλά τα πράγματα γίνονται λίγο πιο δύσκολα μόλις επεκταθείτε πέρα από τις ομάδες ένα και δύο. Θυμηθείτε ότι οι ενώσεις επιθυμούν ένα ουδέτερο ή μηδενικό καθαρό φορτίο. Το θετικό φορτίο του κατιόντος πρέπει να εξισορροπεί το αρνητικό φορτίο του ανιόντος.
Τα στοιχεία των ομάδων τρία-δώδεκα, που ονομάζονται μέταλλα μετάπτωσης, χάνουν διαφορετικούς αριθμούς ηλεκτρονίων ανάλογα με την κατάσταση. Σχηματίζουν κατιόντα με διαφορετικά φορτία, δημιουργώντας μοναδικές ενώσεις με ανόμοιες ιδιότητες. Μπορείτε να προσδιορίσετε το φορτίο ενός κατιόντος μετάλλου μεταπτώσεως εξισώνοντάς το με την αντίθετη τιμή του δεδομένου συστατικού του ανιόντος, λαμβάνοντας υπόψη όλα τα άτομα.
Το σύστημα μετοχών
Για να αντιμετωπίσετε αυτές τις παραλλαγές, χρησιμοποιήστε το Σύστημα Αποθεμάτων. Αυτή η μέθοδος χρησιμοποιεί λατινικούς αριθμούς για να υποδείξει το φορτίο του κατιόντος σε μια ένωση. Πρέπει να τοποθετήσετε τους αριθμούς σε παρένθεση και να ακολουθήσετε τη λέξη "ion."
Το Feand Fe είναι βασικά παραδείγματα. Το σίδερο μπορεί να φέρει είτε φόρτιση 2+ είτε φόρτιση 3+. Εάν το ανιόν φέρει φορτίο 3, επιλέξτε ένα φορτίο 3+ για το κατιόν. Εάν το ανιόν φέρει φορτίο 2, επιλέξτε ένα φορτίο 2+ για το κατιόν. Μπορείτε να διευκρινίσετε ποια είναι η περίπτωση καλώντας το κατιόν είτε "σίδερο(II)" είτε "σίδερο(III)."
Για να επαναλάβουμε, στοιχεία που σχηματίζουν ιόντα με ένα μόνο φορτίο δεν χρειάζεται να γράφονται με αυτόν τον τρόπο. Η μέθοδος εξαλείφει την ασάφεια ειδικά σχετικά με τα φορτία μετάλλων μετάπτωσης.
Η διαδικασία εγγραφής του ανιόντος σε αυτή την περίπτωση παραμένει αμετάβλητη. Μπορείτε να τοποθετήσετε το όνομα του στοιχείου ανιόντος μετά το κατιόν του μεταβατικού στοιχείου και το φορτίο του. Για παράδειγμα, η ένωση Co2 Το Cl θα μεταφραζόταν στο όνομα "χλωριούχο κοβάλτιο (II).
Παραδείγματα Δυαδικών Ιονικών Ενώσεων:
- NaCl:χλωριούχο νάτριο
- ZnI2 :ιωδιούχος ψευδάργυρος
- Al2 O3 :οξείδιο αλουμινίου
- FeCl3 :χλωριούχος σίδηρος (III)
- PbO:οξείδιο μολύβδου (II)
Πολυατομικές ιοντικές ενώσεις
Οι πολυατομικές ενώσεις περιέχουν περισσότερους από έναν τύπους ατόμων.
Μπορεί να έχουν ένα μονοατομικό συστατικό και ένα πολυατομικό συστατικό, όπως φαίνεται από το NaNO3 , νιτρικό νάτριο. Ή θα μπορούσαν να έχουν δύο πολυατομικά συστατικά, όπως φαίνεται στο (NH4)2SO4, θειικό αμμώνιο.
Οι πολυατομικές ιοντικές ενώσεις μπορεί αρχικά να φαίνονται περίπλοκες. Επειδή τα ίδια είναι σύνθετα, οι τίτλοι τους περιλαμβάνουν συμβατικές ονομασίες. Αλλά η διαδικασία ονομασίας τους περιλαμβάνει επίσης την εγγραφή του κατιόντος πρώτα, ακολουθούμενο από το ανιόν.
Για παράδειγμα, NaNO3 ονομάζεται «νιτρικό νάτριο». Το νάτριο ονομάζεται σύμφωνα με τους ίδιους κανόνες παραπάνω. Αλλά ΟΧΙ3 , που είναι η δική του ένωση, πρέπει να αναφέρεται ως "νιτρικό". Το (NH4)2SO4 περιέχει δύο πολυατομικά ιόντα, αμμώνιο και θειικό. Ο συνδυασμός του κατιόντος και του συστατικού ανιόντος δίνει "θειικό αμμώνιο".
Παραδείγματα Πολυατομικών Ιονικών Ενώσεων:
- CaCO3 :ανθρακικό ασβέστιο
- NH₄NO3 :νιτρικό αμμώνιο
- KNO3 :νιτρικό κάλιο
- Fe(OH)2 :υδροξείδιο του σιδήρου (II)
- Να3 PO4 :φωσφορικό νάτριο
- Sn3 (PO4 )4 :φωσφορικός κασσίτερος (IV)
Θα πρέπει να είστε εξοικειωμένοι με κοινά πολυατομικά κατιόντα και ανιόντα, ώστε να μπορείτε να τα χρησιμοποιείτε κατά την ονομασία ιοντικών ενώσεων. Το παρακάτω διάγραμμα παρέχει μια περίληψη των κατιόντων και των ανιόντων που πρέπει να γνωρίζετε.
Κοινά πολυατομικά ιόντα:
| Πολυατομικά κατιόντα | Πολυατομικά ανιόντα |
| NH4 :αμμώνιο | ΟΧΙ3 :νιτρικό |
| H3 Ο:υδρόνιο | ΟΧΙ2 :νιτρώδη |
| OH:υδροξείδιο | |
| ClO3 :χλωρικό | |
| ClO2 :χλωρίτης | |
| CrO4 :χρωμικό | |
| CO3 :ανθρακικό | |
| HCO3 :διττανθρακικό | |
| CH3 COO:οξικό | |
| SO4 :θειικό | |
| SO3 :θειώδες | |
| PO4 :φωσφορικό | |
| PO3 :φωσφορώδες | |
| ΣΟ:κυάνιο | |
| C2 O4 :οξαλικό |
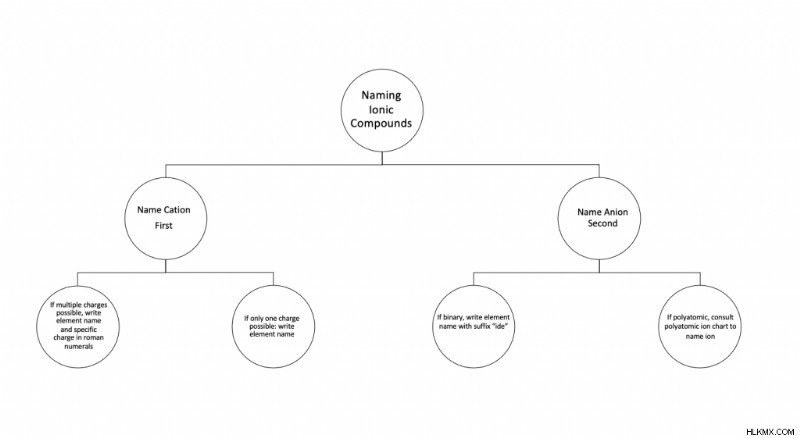
Απλοποιημένα βήματα για την ονομασία ιοντικών ενώσεων
Για να διαβάσετε αυτές τις πληροφορίες σχετικά με την ονομασία ιοντικών ενώσεων, συμβουλευτείτε το ακόλουθο διάγραμμα ροής. Περιλαμβάνει τα βήματα της διαδικασίας ονομασίας σε διαφορετικά σενάρια. Μπορείτε επίσης να δοκιμάσετε ένα φύλλο εργασίας ιοντικής ένωσης.
Ιδιότητες ιοντικών ενώσεων
Οι ιοντικές ενώσεις μοιράζονται πολλές παρόμοιες ιδιότητες. Ας δούμε τι είναι:
- Είναι κρυσταλλικά στερεά
- Είναι σκληρά και εύθραυστα, συχνά σπάνε σε ομαλά επίπεδα όταν θρυμματίζονται
- Έχουν υψηλά σημεία τήξης και βρασμού, λόγω των ισχυρών κρυσταλλικών τους δικτυωμάτων
- Εάν είναι διαλυτά στο νερό, συχνά είναι αδιάλυτα σε μη πολικούς διαλύτες
- Έχουν υψηλές ενθαλπίες εξάτμισης και σύντηξης
- Ως στερεά, είναι μονωτικά και δεν αγώγουν ηλεκτρισμό, αλλά αγώγουν όταν λιώνουν ή όταν διαλύονται στο νερό




