Τι είναι οι δεσμοί υδρογόνου;
Βασικές έννοιες
Δεσμοί υδρογόνου είναι μια ουσιαστική διαμοριακή δύναμη που είναι υπεύθυνη για πολλές μοριακές δράσεις ειδικά σε βιολογικά συστήματα. Σε αυτό το σεμινάριο, θα μάθουμε τον ορισμό των δεσμών υδρογόνου, παραδείγματα και γιατί είναι τόσο σημαντικοί στη χημεία και τη βιολογία.
Θέματα που καλύπτονται σε άλλα άρθρα
- Διαμοριακές δυνάμεις
- Δυνάμεις ιόντων-διπόλων
- Ιωνικοί δεσμοί έναντι ομοιοπολικών δεσμών
- Υδρογόνο
Λεξιλόγιο
- Διαμοριακή δύναμη: δυνάμεις μεταξύ αλληλεπιδρώντων μορίων εντός της ίδιας ουσίας. Αυτές είναι διαφορετικές από τις ενδομοριακές δυνάμεις, οι οποίες είναι δυνάμεις που υπάρχουν μεταξύ ατόμων μέσα σε ένα μόριο.
- Ιωνικός δεσμός: δεσμός που σχηματίζεται λόγω ηλεκτροστατικής έλξης μεταξύ δύο αντίθετα φορτισμένων ιόντων. Π.χ.:Το Na και το Cl σχηματίζουν έναν ιοντικό δεσμό για να δημιουργήσουν NaCl
- Ομοιοπολικός δεσμός: δεσμός που σχηματίζεται λόγω δύο ατόμων που μοιράζονται ηλεκτρόνια. Π.χ.:CO
- Δίπολο: Μερικό φορτίο σε ένα άτομο λόγω της φυσικής κίνησης των ηλεκτρονίων που οδηγεί σε μερικά θετικά και αρνητικά φορτία σε ένα κατά τα άλλα ουδέτερο μόριο.
Τι είναι οι δεσμοί υδρογόνου;
Οι δεσμοί υδρογόνου είναι ένας τύπος διαμοριακής δύναμης που εμφανίζεται μεταξύ του υδρογόνου σε ένα μόριο και ενός ηλεκτραρνητικού ατόμου ενός άλλου μορίου. Συγκεκριμένα, εμφανίζονται μόνο μεταξύ ενώσεων που περιέχουν υδρογόνο και ένα ή περισσότερα από τα ακόλουθα άτομα:οξυγόνο, φθόριο ή άζωτο. Ένας έξυπνος τρόπος για να θυμάστε ότι οι δεσμοί υδρογόνου συμβαίνουν μόνο με αυτά τα μόρια είναι, «η χημεία είναι FON (διασκεδαστική).» Οι δεσμοί υδρογόνου είναι οι ισχυρότεροι από τους τρεις τύπους διαμοριακών δυνάμεων.
Είναι οι δεσμοί υδρογόνου ίδιοι με τους ομοιοπολικούς δεσμούς;
Όχι . Οι δεσμοί υδρογόνου είναι ένα ενδιάμεσο μοριακή δύναμη, ενώ οι ομοιοπολικοί δεσμοί είναι ένα ενδο μοριακή δύναμη. Αυτοί οι δεσμοί υπάρχουν συχνά σε πολλές ομοιοπολικές ενώσεις αλλά είναι πολύ διαφορετικοί από τους ομοιοπολικούς δεσμούς. Αν και αυτοί οι δεσμοί είναι ισχυροί, δεν είναι τόσο ισχυροί όσο οι ομοιοπολικοί δεσμοί και συχνά σπάνε και αναμορφώνονται συνεχώς.
Πώς δημιουργούνται οι δεσμοί υδρογόνου;
Αυτοί οι δεσμοί συμβαίνουν όταν το υδρογόνο σχηματίζει ένα θετικό δίπολο σε ένα μόριο και το φθόριο, το οξυγόνο ή το άζωτο σχηματίζουν ένα αρνητικό δίπολο σε ένα άλλο μόριο. Το θετικό δίπολο του υδρογόνου έλκεται από το αρνητικό δίπολο στο ηλεκτραρνητικό άτομο, δημιουργώντας μια έλξη μεταξύ των δύο μορίων.
Παραδείγματα δεσμών υδρογόνου
Η κατανόηση των δεσμών υδρογόνου γίνεται πιο απλή όταν εξετάζουμε κοινά παραδείγματα δεσμών υδρογόνου.
Δεσμός υδρογόνου στο νερό
Ο δεσμός υδρογόνου στο νερό είναι συχνά το πιο κοινό παράδειγμα αυτών των δεσμών λόγω της σημασίας τους σε πολλές ιδιότητες του νερού. Στο νερό, ο δεσμός υδρογόνου εμφανίζεται μεταξύ του οξυγόνου ενός μορίου και του υδρογόνου ενός άλλου μορίου.

Αυτοί οι δεσμοί έχουν ως αποτέλεσμα σημαντικές ιδιότητες στο νερό όπως η συνοχή (η ικανότητα του νερού να κολλάει στον εαυτό του), η πρόσφυση (η ικανότητα του νερού να κολλάει σε άλλα μόρια), η επιφανειακή τάση, η υψηλή ειδική θερμότητα και οι ιδιότητες του διαλύτη.
Δεσμός υδρογόνου στο DNA
Οι δεσμοί υδρογόνου είναι εξαιρετικά σημαντικοί στη βιολογία, καθώς είναι ο λόγος για τη δομή του DNA και τις ιδιότητές του. Αυτοί οι δεσμοί είναι υπεύθυνοι για τις συνδέσεις μεταξύ των δύο κλώνων του DNA μεταξύ των ζευγών βάσεων νουκλεοτιδίων. Η αδενίνη και η θυμίνη σχηματίζουν δύο δεσμούς υδρογόνου μεταξύ τους και η κυτοσίνη και η γουανίνη σχηματίζουν τρεις. Αυτοί οι δεσμοί διατηρούν το DNA στο σχηματισμό της διπλής έλικας. Επιπλέον, αυτοί οι δεσμοί είναι σημαντικοί για την αντιγραφή του DNA, καθώς η ισχύς των δεσμών κρατά τους κλώνους μαζί, αλλά είναι αρκετά αδύναμοι ώστε να σπάσουν με κάποια δύναμη, επιτρέποντας τον διαχωρισμό των κλώνων όταν έρθει η ώρα για αντιγραφή. /P> 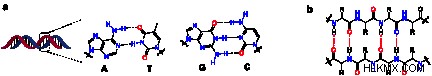
Αυτοί οι δεσμοί είναι επίσης ο λόγος που το DNA και πολλές πρωτεΐνες έχουν βέλτιστο pH και θερμοκρασία. Εάν το pH είναι χαμηλό, αυτό σημαίνει ότι υπάρχει υψηλή συγκέντρωση ιόντων Η. Δεδομένου ότι αυτά τα ιόντα είναι αντιδραστικά, μπορούν να σπάσουν τους δεσμούς υδρογόνου και να τους αντικαταστήσουν με δεσμό στο ηλεκτραρνητικό άτομο. Το ίδιο μπορεί να συμβεί όταν το pH είναι υψηλό, που σημαίνει ότι υπάρχει υψηλή συγκέντρωση ιόντων ΟΗ. Το αρνητικό οξυγόνο είναι ελκυστικό για τα υδρογόνα, γεγονός που μπορεί να έχει ως αποτέλεσμα τη διάσπαση του δεσμού και το σχηματισμό νέου δεσμού μεταξύ του οξυγόνου στο υδροξείδιο και του υδρογόνου στο ζεύγος βάσεων του DNA. Διαβάστε περισσότερα για το pH εδώ.
Αυτοί οι δεσμοί μπορούν επίσης να σπάσουν από τη θερμοκρασία. Καθώς το σύστημα θερμαίνεται, τα μόρια αρχίζουν να κινούνται πιο γρήγορα και λαμβάνουν αρκετή ενέργεια για να σπάσουν τον δεσμό υδρογόνου. Δεδομένου ότι αυτοί οι δεσμοί είναι απαραίτητοι για τη δομή του DNA και πολλών πρωτεϊνών, μπορούν να οδηγήσουν σε επιζήμιες αλλαγές στα βιολογικά συστήματα.
Δεσμός υδρογόνου σε φάρμακα
Οι δεσμοί υδρογόνου είναι απαραίτητοι όταν εξετάζουμε τη σύνθεση ενός φαρμάκου και πώς θα αλληλεπιδράσει στο σώμα. Συγκεκριμένα, εάν ένα φάρμακο δρα σε ένα συγκεκριμένο μόριο-στόχο, πρέπει να συνδεθεί με το μόριο με κάποιο τρόπο προκειμένου να αλλάξει η λειτουργία του. Προκειμένου να συμβεί αυτή η δέσμευση, οι δεσμοί υδρογόνου είναι απαραίτητοι καθώς επιτρέπουν στο φάρμακο να συνδέεται στενά σε μια ενεργή θέση σε ένα μόριο. Αυτό μπορεί επίσης να φανεί στις αλληλεπιδράσεις ενζύμου-υποστρώματος, όπου οι δεσμοί υδρογόνου επιτρέπουν τη στενή αλλά αναστρέψιμη σύνδεση.
Δεσμός υδρογόνου και σημείο βρασμού
Όπως αναφέρθηκε προηγουμένως, οι δεσμοί υδρογόνου είναι η ισχυρότερη διαμοριακή δύναμη. Ως αποτέλεσμα, όταν υπάρχει αύξηση της πίεσης ή της θερμοκρασίας μιας ουσίας, αυτοί οι δεσμοί προκαλούνται. Δεδομένου ότι αυτοί οι δεσμοί είναι ισχυροί, χρειάζεται περισσότερη ενέργεια για να σπάσουν αυτοί οι δεσμοί από ό,τι για να σπάσει ο Van der Waal ή οι δυνάμεις διπόλου-διπόλου.
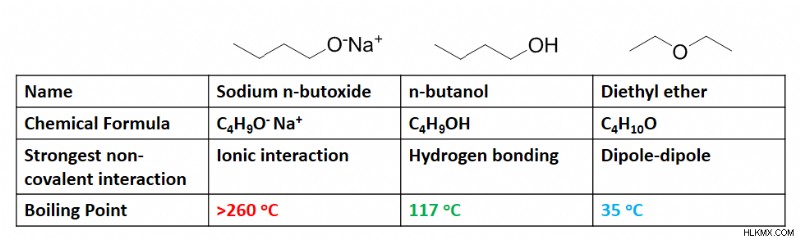
Για παράδειγμα, αυτός ο πίνακας απεικονίζει τη δραματική αλλαγή στο σημείο βρασμού που συμβαίνει όταν υπάρχουν δεσμοί υδρογόνου σε μια ένωση. Σε αυτή την περίπτωση, το σημείο βρασμού τριπλασιάζεται με μια μικρή μόνο αλλαγή στη δομή του μορίου, επιτρέποντας την εισαγωγή αυτών των δεσμών. Εξακολουθούν να είναι πιο αδύναμοι από τους ομοιοπολικούς ή ιοντικούς δεσμούς όπως φαίνεται παραπάνω, αλλά είναι σαφές ότι η δύναμή τους επιτρέπει πρόσθετη σταθερότητα που οδηγεί σε δραματική αλλαγή στο σημείο βρασμού.
Περαιτέρω ανάγνωση
- Επιφανειακή τάση και πίεση ατμών
- Τι είναι η ειδική θερμότητα;
- Τυπική χρέωση
- Τι είναι η ελεύθερη ενέργεια του Gibb;




