Διαφορά μεταξύ Ισομορφισμού και Πολυμορφισμού
Κύρια διαφορά – Ισομορφισμός έναντι πολυμορφισμού
Στη φύση, τα στοιχεία και οι ενώσεις μπορούν να υπάρχουν σε διαφορετικούς συνδυασμούς, έχοντας διαφορετικές δομές ή μορφολογίες. Η δομή μιας ένωσης καθορίζει τις περισσότερες από τις φυσικές ιδιότητες και μερικές φορές τις χημικές ιδιότητες αυτής της ένωσης. Ο όρος «μορφισμός ” αναφέρεται στη μορφολογία. Είναι η εξωτερική εμφάνιση. Επομένως, ο ισομορφισμός και ο πολυμορφισμός είναι δύο όροι που χρησιμοποιούνται για να περιγράψουν τη μορφολογία των χημικών ουσιών. Η ύπαρξη μιας ουσίας σε περισσότερες από μία κρυσταλλικές μορφές είναι γνωστή ως πολυμορφισμός. Εάν αυτή η ουσία είναι ένα μόνο στοιχείο, τότε ονομάζεται αλλοτροπία και όχι πολυμορφισμός. Αν δύο ή περισσότερες διαφορετικές ουσίες παρουσιάζουν την ίδια μορφολογία, τότε ονομάζεται ισομορφισμός. Η κύρια διαφορά μεταξύ ισομορφισμού και πολυμορφισμού είναι ότι ο ισομορφισμός περιγράφει την παρουσία της ίδιας μορφολογίας σε διαφορετικές ουσίες, ενώ ο πολυμορφισμός περιγράφει την παρουσία διαφορετικών μορφολογιών της ίδιας ουσίας.
Βασικές περιοχές που καλύπτονται
1. Τι είναι Ισομορφισμός
– Ορισμός, εξήγηση με παραδείγματα
2. Τι είναι Πολυμορφισμός
– Ορισμός, εξήγηση με παραδείγματα
3. Ποια είναι η διαφορά μεταξύ Ισομορφισμού και Πολυμορφισμού
– Σύγκριση βασικών διαφορών
Βασικοί όροι:αλλοτροπία, ισομορφισμός, ισομορφία, ορυκτά, μορφολογία, πολυμορφία, πολυμορφισμός 
Τι είναι Ισομορφισμός
Ισομορφισμός είναι η ομοιότητα στην κρυσταλλική δομή διαφορετικών ενώσεων. Οι ενώσεις αυτές ονομάζονται ισόμορφες ουσίες. Στον απλούστερο ορισμό, οι ισόμορφες ουσίες είναι σχεδόν ίδιες στο σχήμα τους.
Οι ισομορφικές ουσίες αποτελούνται από την ίδια ατομική αναλογία. Επομένως, οι εμπειρικοί τύποι αυτών των ισομορφών ουσιών είναι οι ίδιοι. Ωστόσο, δεδομένου ότι αυτές οι ουσίες αποτελούνται από συνδυασμούς διαφορετικών ατόμων, οι χημικές και φυσικές ιδιότητες των ισομορφών ουσιών είναι διαφορετικές μεταξύ τους. Τέτοιες ιδιότητες περιλαμβάνουν μάζα, πυκνότητα, χημική αντιδραστικότητα κ.λπ.
Παραδείγματα ισομορφισμού
Μερικά από τα παραδείγματα για ουσίες που παρουσιάζουν ισομορφισμό φαίνονται παρακάτω.
- CaCO3 και NaNO3
Και οι δύο αυτές ουσίες υπάρχουν σε τριγωνικό σχήμα. Η ατομική αναλογία αυτών των ισομορφών ουσιών είναι η ίδια (1:1:3).
Αλλά οι φυσικές και χημικές ιδιότητες είναι διαφορετικές. Για παράδειγμα, η μοριακή μάζα του CaCO3 είναι 100 g/mol ενώ η μοριακή μάζα του NaNO3 είναι περίπου 85 g/mol.
- Να3 PO4 και N3 AsO4
Και οι δύο ουσίες έχουν τετραεδρικό σχήμα. Η ατομική αναλογία και των δύο δομών είναι 3:1:4. Αλλά οι φυσικές και χημικές ιδιότητες είναι διαφορετικές.
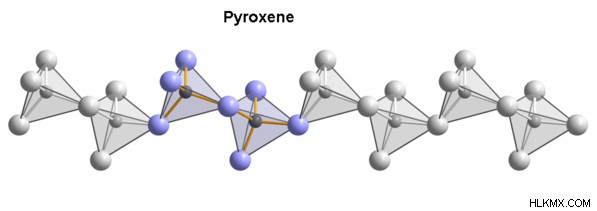
Εικόνα 01:Διαφορετικές ισόμορφες ενώσεις κρυσταλλώνονται μαζί για να σχηματίσουν πυροξένιο.
Ο ισομορφισμός μπορεί να βρεθεί συχνά στα ορυκτά. Δεδομένου ότι οι κρυσταλλικές δομές είναι παρόμοιες μεταξύ τους, αυτές οι ισόμορφες ουσίες μπορούν μερικές φορές να κρυσταλλωθούν μαζί. Τα περισσότερα ορυκτά αποτελούνται από αυτόν τον τύπο δομής που έχει πολλές διαφορετικές ενώσεις αναμεμειγμένες μεταξύ τους, σχηματίζοντας την ίδια κρυσταλλική δομή. Μερικά από τα παραδείγματα περιλαμβάνουν άστριο, γρανάτη και πυροξένιο.
Τι είναι ο Πολυμορφισμός
Πολυμορφισμός είναι η παρουσία διαφορετικών κρυσταλλικών μορφών της ίδιας ένωσης. Με άλλα λόγια, εάν μια συγκεκριμένη ένωση μπορεί να βρεθεί σε διαφορετικά σχήματα, αυτό το φαινόμενο ονομάζεται πολυμορφισμός. Η ένωση που εμφανίζει πολυμορφισμό ονομάζεται πολυμορφική ουσία.
Οι πολυμορφικές ουσίες παρουσιάζουν ομοιότητες αλλά και διαφορές. Τις περισσότερες φορές, οι χημικές ιδιότητες αυτών των πολυμορφικών μορφών μιας συγκεκριμένης ουσίας είναι οι ίδιες, αλλά οι φυσικές ιδιότητες μπορεί να είναι διαφορετικές. Ωστόσο, οι χημικοί τύποι των πολυμορφικών μορφών είναι οι ίδιοι αφού πρόκειται για την ίδια ένωση. Για παράδειγμα, το CaCO3 Η ένωση μπορεί να υπάρχει είτε σε ορθορομβική μορφή είτε σε εξαγωνική μορφή.
Όταν ένα στοιχείο εμφανίζει πολυμορφισμό, ονομάζεται αλλοτροπία. Όταν ένα στοιχείο βρίσκεται σε διαφορετικές μορφές διατάξεων, αυτές οι ενώσεις ονομάζονται αλλοτρόπα. Για παράδειγμα, ο άνθρακας μπορεί να βρεθεί είτε ως διαμάντι είτε ως γραφίτης. Έχουν διαφορετικές χημικές και φυσικές ιδιότητες, αλλά αποτελούνται μόνο από άτομα άνθρακα.
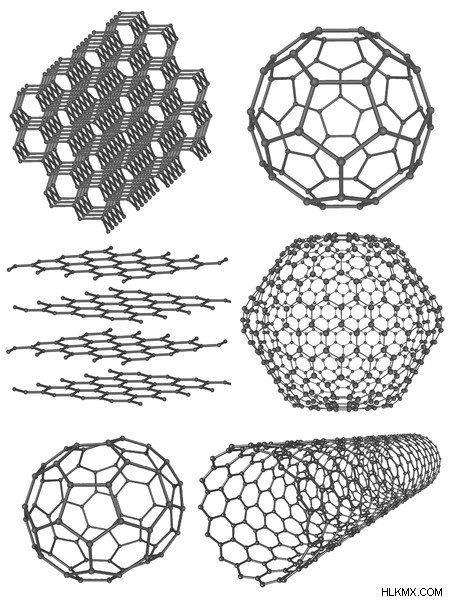
Εικόνα 2:Αλλοτρόπα του άνθρακα
Η παραπάνω εικόνα δείχνει τον πολυμορφισμό των στοιχείων άνθρακα. Αυτές οι διαφορετικές μορφές ή ενώσεις ονομάζονται αλλότροπα.
Διαφορά μεταξύ Ισομορφισμού και Πολυμορφισμού
Ορισμός
Ισομορφισμός: Ισομορφισμός είναι η ομοιότητα στην κρυσταλλική δομή διαφορετικών ενώσεων.
Πολυμορφισμός: Πολυμορφισμός είναι η παρουσία διαφορετικών κρυσταλλικών μορφών της ίδιας ένωσης.
Σχήμα
Ισομορφισμός: Το κρυσταλλικό σχήμα των ισομορφικών ενώσεων είναι πανομοιότυπο μεταξύ τους.
Πολυμορφισμός: Το κρυσταλλικό σχήμα των πολυμορφικών ουσιών διαφέρει μεταξύ τους.
Σύνθετο
Ισομορφισμός: Ο ισομορφισμός αφορά δύο ή περισσότερες ενώσεις τη φορά.
Πολυμορφισμός: Ο πολυμορφισμός αφορά μία ένωση.
Στοιχεία
Ισομορφισμός: Ο ισομορφισμός δεν μπορεί να φανεί σε στοιχεία.
Πολυμορφισμός: Ο πολυμορφισμός μπορεί να παρατηρηθεί σε στοιχεία.
Ατομική αναλογία
Ισομορφισμός: Οι ατομικές αναλογίες των ισομορφών ενώσεων είναι οι ίδιες.
Πολυμορφισμός: Η ατομική αναλογία πολυμορφικών ενώσεων μπορεί να είναι ή να μην είναι η ίδια.
Συμπέρασμα
Ορισμένες ενώσεις μπορούν να κατηγοριοποιηθούν είτε ως ισόμορφες είτε ως πολυμορφικές ανάλογα με το σχήμα και τη σύνθεση της ένωσης. Εάν μια συγκεκριμένη ένωση μπορεί να βρεθεί σε διαφορετικά σχήματα, τότε ονομάζεται πολυμορφισμός. Εάν διαφορετικές ενώσεις μπορούν να βρεθούν σε ίδιο σχήμα, τότε ονομάζεται ισομορφισμός. Η κύρια διαφορά μεταξύ ισομορφισμού και πολυμορφισμού είναι ότι ο ισομορφισμός περιγράφει την ύπαρξη της ίδιας μορφολογίας σε διαφορετικές ουσίες ενώ ο πολυμορφισμός περιγράφει την ύπαρξη διαφορετικών μορφολογιών της ίδιας ουσίας.




