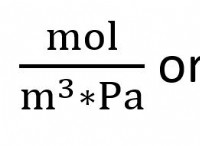Ενδόθερμες vs Εξώθερμες Αντιδράσεις
Οι αντιδράσεις μπορούν είτε να παράγουν είτε να καταναλώνουν ενέργεια με τη μορφή θερμότητας. Διαβάστε παρακάτω για να μάθετε πώς να διακρίνετε τις ενδόθερμες και εξώθερμες αντιδράσεις, να τις συνδέσετε με άλλες έννοιες της χημείας και να δείτε πρακτικά παραδείγματα!
Σχετικά θέματα
- Ενέργεια ομολόγων
- Ενθαλπία αντίδρασης
- Ενθαλπία καύσης
- Ενέργεια ενεργοποίησης
- Νόμος του Hess
Ενδόθερμος και εξώθερμος ορισμός
Τι είναι η ενδόθερμη αντίδραση; Οι ενδόθερμες αντιδράσεις απορροφούν ενέργεια από το περιβάλλον τους, επειδή τα προϊόντα έχουν υψηλότερη ενέργεια από τα αντιδρώντα.
Τι είναι μια εξώθερμη αντίδραση; Οι εξώθερμες αντιδράσεις απελευθερώνουν ενέργεια στο περιβάλλον τους, επειδή τα προϊόντα έχουν χαμηλότερη ενέργεια από τα αντιδρώντα. Μπορείτε να το σκεφτείτε οπτικά χρησιμοποιώντας ένα διάγραμμα ενέργειας αντίδρασης, όπως φαίνεται παρακάτω:
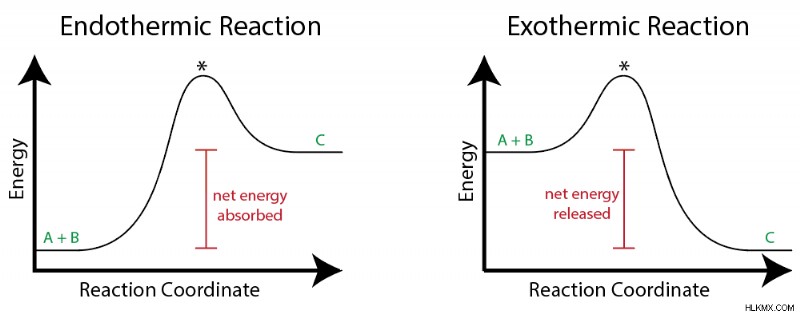
Εμφανίζεται μια αντίδραση κάθε είδους, στην οποία τα αντιδρώντα Α και Β υφίστανται μετατροπή σε προϊόν Γ. Εάν η ενέργεια του Γ είναι μεγαλύτερη από την ενέργεια των Α και Β, τότε η αντίδραση είναι ενδόθερμη και απορροφάται καθαρή ενέργεια . Εάν, από την άλλη πλευρά, το C έχει χαμηλότερη ενέργεια από το Α και το Β, η αντίδραση είναι εξώθερμη και απελευθερώνεται καθαρή ενέργεια. Αυτή η καθαρή αλλαγή στην ενέργεια ονομάζεται ενθαλπία της αντίδρασης.
Για να πραγματοποιηθεί η ενδόθερμη αντίδραση, πρέπει να προσθέσουμε θερμότητα στο σύστημα, διαφορετικά δεν θα υπάρχει αρκετή διαθέσιμη ενέργεια για να σχηματιστεί το προϊόν Γ. Για να συμβεί η εξώθερμη αντίδραση, πρέπει να αφαιρέσουμε θερμότητα από το σύστημα, διαφορετικά θα είναι πολύ υψηλή σε ενέργεια για να σχηματίσει C.
Εάν εκτελέσουμε μια αντίστροφη αντίδραση, ξεκινώντας από το C και κάνοντας την αντίστροφη αντίδραση πίσω στο Α και Β, τότε ο τύπος της αντίδρασης θα ήταν αντίθετος. Εάν το A + B → C είναι ενδόθερμο, η αντίστροφη αντίδρασή του C → A + B θα είναι εξώθερμη και το αντίστροφο.
Παραδείγματα ενδόθερμης και εξώθερμης αντίδρασης
Ενδόθερμες και εξώθερμες αντιδράσεις είναι παντού, ακόμα και όταν δεν παρατηρούμε την αλλαγή στη θερμοκρασία που δημιουργούν. Ακολουθούν μερικά παραδείγματα για κάθε τύπο αντίδρασης.
Εξώθερμες αντιδράσεις
Καθίζηση οξικού νατρίου
Ορισμένα είδη θερμαντικών χεριών επαναχρησιμοποιήσιμων περιέχουν ένα υπερκορεσμένο διάλυμα οξικού νατρίου. Όταν λυγίζετε τη συσκευασία, μικροσκοπικά κομμάτια μετάλλου επιτρέπουν στο οξικό νάτριο να «πυρηνώσει» ή να αρχίσει να σχηματίζει κρυστάλλους. Ο σχηματισμός και η ανάπτυξη αυτών των κρυστάλλων είναι μια εξώθερμη διαδικασία, επομένως θερμαίνει τους θερμαντήρες χεριών.
Σκουριάζει
Η οξείδωση του μετάλλου σιδήρου για σχηματισμό οξειδίου ή σκουριάς είναι επίσης μια εξώθερμη διαδικασία! Συνήθως αυτό είναι δύσκολο να το παρατηρήσετε, αφού κανείς δεν δίνει σημασία στη θερμοκρασία του μετάλλου που σκουριάζει. Ωστόσο, αυτή η αντίδραση χρησιμοποιείται σε μια έκδοση μιας χρήσης των θερμαντικών χεριών που αναφέρονται παραπάνω. Σε αυτήν την έκδοση, η αφαίρεση των θερμαντικών από τη συσκευασία τους εκθέτει τη σκόνη σιδήρου στον αέρα και η αντίδραση σκουριάς προκαλεί θέρμανση. Αυτή είναι τεχνικά μια μορφή καύσης, για την οποία μπορείτε να μάθετε περισσότερα στην επόμενη ενότητα!
Κύση
Οι αντιδράσεις καύσης είναι εξώθερμες. Αυτός είναι ο λόγος για τον οποίο η καύση καυσίμου όπως ξύλο ή αέριο εκπέμπει θερμότητα που κρατά ένα σπίτι (ή μια ομάδα κατασκηνωτών) ζεστό. Αυτό που αισθάνεστε όταν κάθεστε κοντά σε μια φωτιά είναι η θερμότητα που απελευθερώνεται από την αντίδραση της καύσης.

Σημείωση:Ένα συνηθισμένο λάθος είναι να πιστεύουμε ότι επειδή απαιτείται μικρή ποσότητα θερμότητας για να ξεκινήσει μια αντίδραση καύσης (σκεφτείτε να χτυπήσετε ένα σπίρτο) που κάνει την καύση ενδόθερμη. Απαιτείται εισαγωγή θερμότητας για να ξεπεραστεί η ενέργεια ενεργοποίησης της αντίδρασης. Μόλις παρέχεται αυτή η μικρή ποσότητα θερμότητας, η αντίδραση απελευθερώνει θερμότητα συνολικά. Αυτός είναι ο λόγος που δεν χρειάζεται να προσθέτετε συνεχώς θερμότητα στη φωτιά για να συνεχίσει να καίει!
Διάλυση NaOH
Το υδροξείδιο του νατρίου, μια ισχυρή βάση, και το θειικό οξύ, ένα ισχυρό οξύ, αλληλεπιδρούν έντονα με το νερό και απελευθερώνουν πολλή θερμότητα όταν διαλύονται. Αυτός είναι ο λόγος που οι χημικοί προσθέτουν πάντα πυκνά οξέα και βάσεις στο νερό και ποτέ το αντίστροφο. Εάν προσθέσετε νερό σε μία από αυτές τις χημικές ουσίες, μπορεί να απελευθερώσουν μια επικίνδυνη ποσότητα θερμότητας.
Ενδόθερμες Αντιδράσεις
Διάλυση NaCl
Η διάλυση του χλωριούχου νατρίου, του κανονικού επιτραπέζιου αλατιού, είναι μια ενδόθερμη διαδικασία. Αυτό σημαίνει ότι αν το διαλύσετε σε νερό, το νερό θα γίνει ελαφρώς πιο κρύο, λόγω της ενέργειας που απορροφάται από τη διάλυση των ιόντων. Αυτό ισχύει για πολλά άλλα άλατα, συμπεριλαμβανομένου του χλωριούχου καλίου (KCl) και του διττανθρακικού νατρίου (NaHCO3 ή μαγειρική σόδα). Δεν ισχύει απαραίτητα για όλα τα άλατα, ωστόσο. Η διάλυση μπορεί να είναι ενδόθερμη και εξώθερμη ανάλογα με την ουσία που διαλύεται!
Υδρόλυση
Η υδρόλυση είναι ένας τύπος αντίδρασης που περιλαμβάνει πολλές βιοχημικές και οργανικές αντιδράσεις. Σε μια αντίδραση υδρόλυσης, ένα μόριο νερού αντιδρά με έναν δεσμό σε ένα μόριο για να σπάσει το μόριο σε δύο κομμάτια. Αυτή είναι μια ενδόθερμη διαδικασία, επομένως για να εκτελέσετε μια αντίδραση όπως αυτή στο εργαστήριο, ίσως χρειαστεί να θερμάνετε τη φιάλη αντίδρασης.
Μετουσίωση πρωτεΐνης
Όταν βράζετε ένα αυγό ή μαγειρεύετε κρέας, προκαλείτε τη «μετουσίωσή» ή το ξεδίπλωμα των μορίων πρωτεΐνης σε αυτά τα τρόφιμα. Αυτό σημαίνει ότι η διαδικασία μετουσίωσης είναι ενδόθερμη, επειδή πρέπει να απορροφά θερμική ενέργεια αντί να την απελευθερώνει.
Συνδέσεις
Η Αρχή του Le Chatelier μας επιτρέπει να ευνοούμε τα αντιδρώντα ή τα προϊόντα μιας αντίδρασης χρησιμοποιώντας θερμοκρασία. Αν αυξήσουμε τη θερμοκρασία, μια ενδόθερμη αντίδραση προχωρά περαιτέρω προς την ολοκλήρωση, αφού καταναλώνει την επιπλέον θερμική ενέργεια που παρέχουμε. Εάν η αντίδραση είναι εξώθερμη, πρέπει να μειωθούμε η θερμοκρασία για να ευνοήσει τα προϊόντα, επειδή η αντίδραση παράγει θερμότητα. Η αύξηση της θερμοκρασίας για τις εξώθερμες αντιδράσεις ή η μείωση της θερμοκρασίας για τις ενδόθερμες αντιδράσεις, αναγκάζει την αντίδραση να πάει προς τα πίσω, υποθέτοντας ότι οι αντιδράσεις είναι αναστρέψιμες.