Γιατί τα άτομα με 8 ηλεκτρόνια σθένους είναι τόσο σταθερά;
Τα άτομα με 8 ηλεκτρόνια στο κέλυφος σθένους έχουν γεμίσει πλήρως τα τελευταία τροχιακά και επομένως είναι τα πιο σταθερά, καθώς η ηλεκτρονική τους διαμόρφωση είναι παρόμοια με αυτή του πλησιέστερου ευγενούς αερίου.
Ο αριθμός 8 είναι ένας τυχερός αριθμός, σύμφωνα με πολλούς ασιατικούς πολιτισμούς. Οι Κινέζοι θεωρούν τον αριθμό τυχερό επειδή η προφορά του bā είναι παρόμοιο με το fā, που σημαίνει πλούτος. Είναι ενδιαφέρον ότι οι Θερινοί Ολυμπιακοί Αγώνες του Πεκίνου πραγματοποιήθηκαν στις 8 Αυγούστου 2008 στις 8 δευτερόλεπτα και 8 λεπτά μετά τις 8 μ.μ.
Οι Ιάπωνες τον θεωρούν τυχερό αριθμό όσον αφορά την ιδέα της ευημερίας, καθώς το σενάριο για το 8 στα Ιαπωνικά είναι 八, το οποίο διευρύνεται σταδιακά, υποδηλώνοντας αυξανόμενο πλούτο.
Η σημασία του "8" στη Χημεία
Στη χημεία, το 8 δεν είναι ένας τυχερός αριθμός, από μόνος του, αλλά ένας αριθμός που δείχνει σταθερότητα. Ο κανόνας του 8 ή ο κανόνας της Οκτάδας είναι η τάση των ατόμων να έχουν οκτώ ηλεκτρόνια στο κέλυφος σθένους.
Οκτώ ηλεκτρόνια σε αυτό το τελικό κέλυφος επιτρέπουν στα άτομα να είναι σταθερά και μη αντιδραστικά.
Τα ευγενή αέρια, για παράδειγμα, είναι μερικά από τα πιο μη αντιδραστικά χημικά στοιχεία που μπορεί κανείς να βρει στη φύση. Συνθέτουν το ακροδεξιό τμήμα του περιοδικού πίνακα και είναι γνωστά ως ευγενή αέρια επειδή είναι τόσο αυτάρκεις! Έχουν 2, 8, 18 ή 36 ηλεκτρόνια στο τελευταίο τους κέλυφος.
Τα ευγενή αέρια συνθέτουν το ακροδεξιό τμήμα του περιοδικού πίνακα (Photo Credit :julie deshaies/Shutterstock)
Τα άτομα τείνουν να είναι αντιδραστικά όταν το κέλυφος σθένους (ή το εξωτερικό κέλυφος) τους είναι ατελές. Για να επιτύχει μια πλήρη κατάσταση ή ένα κλειστό κέλυφος, ένα άτομο κάνει ένα από τα 3 πράγματα:να χάσει, να κερδίσει ή να μοιραστεί τα ηλεκτρόνια του με άλλα άτομα.
Ένα άτομο δεν είναι τόσο απλό όσο νομίζουμε - ένας πυρήνας με λίγα πρωτόνια και ηλεκτρόνια - αλλά είναι μάλλον ένας συνδυασμός πολλών κελυφών διατεταγμένων σε ομόκεντρους κύκλους, που ονομάζεται ηλεκτρονική διαμόρφωση του ατόμου. Το κέλυφος σθένους μπορεί να είναι μια δύσκολη ιδέα για άμεση μετάβαση, οπότε ας ξεκινήσουμε με τα βασικά.
Ποια είναι η ηλεκτρονική διαμόρφωση ενός ατόμου;
Η ηλεκτρονική διαμόρφωση ενός ατόμου είναι η κατανομή των ηλεκτρονίων σε ένα άτομο. Φανταστείτε το ηλιακό μας σύστημα, με τους πλανήτες να περιστρέφονται γύρω από τον ήλιο. Παρομοίως, το άτομο έχει ηλεκτρόνια που περιστρέφονται γύρω από τον κεντρικό πυρήνα του σε διακριτά κελύφη ηλεκτρονίων.
Το μοντέλο Bohr, που ανακαλύφθηκε από τον Δανό φυσικό Niels Bohr το 1913, ήταν το πρώτο μοντέλο που πρότεινε ότι τα ηλεκτρόνια σε ένα άτομο περιέχονται σε φλοιούς ηλεκτρονίων. Αυτό το κέλυφος επιτρέπει μόνο σε έναν ορισμένο αριθμό ηλεκτρονίων να αποτελούν μέρος του. Ένας άλλος επιστήμονας προώθησε αυτή τη θεωρία και βρήκε ένα μοναδικό εύρημα κατά τη διάρκεια μιας από τις διαλέξεις του.
Ο Αμερικανός φυσικοχημικός και καθηγητής Gilbert Newton Lewis δήλωσε ότι, όπως το άτομο ηλίου, με 2 ηλεκτρόνια στη στιβάδα του σθένους, 8 ηλεκτρόνια μπορεί να είναι διατεταγμένα σε διαδοχικά κελύφη, μιμούμενοι τις γωνίες ενός κύβου. Αυτή η διάταξη οδήγησε σε μια πολύ σταθερή κατάσταση των ατόμων, λόγω της ομοιότητάς τους με ευγενή αέρια.
Το ντο κέλυφος ενός ηλεκτρονίου θα φιλοξενήσει 2n2 αριθμό ηλεκτρονίων, όπου n είναι ο κύριος κβαντικός αριθμός ή το επίπεδο ενέργειας. Στην κβαντομηχανική, υπάρχουν 4 κβαντικοί αριθμοί που εκχωρούνται σε κάθε ηλεκτρόνιο ενός ατόμου για να προσδιορίσουν μια μοναδική κατάσταση του ηλεκτρονίου. Αυτές οι κβαντικές καταστάσεις ενός ηλεκτρονίου συνθέτουν την κυματική φύση ή τροχιακό ενός ηλεκτρονίου. Αυτό αποτελεί μέρος της προηγμένης χημείας, η οποία ξεφεύγει από το πεδίο εφαρμογής αυτού του άρθρου. Συνιστάται περαιτέρω ανάγνωση, εάν απαιτείται/επιθυμείται.
Έτσι, αν n=1, δηλαδή το πρώτο φλοιό, ο αριθμός των ηλεκτρονίων θα είναι 2 για αυτό το φλοιό. Για n=2, ο αριθμός θα είναι 8, και ούτω καθεξής (2, 8, 18, 32…). Τα κοχύλια είναι επίσης γνωστά ως K, L, M, N και ούτω καθεξής. Η ενέργεια που σχετίζεται με τα ενεργειακά επίπεδα αυξάνεται καθώς απομακρυνόμαστε από τον πυρήνα. Τα αντίθετα φορτία των ηλεκτρονίων και του πυρήνα στα χαμηλότερα ενεργειακά επίπεδα προκαλούν τα ηλεκτρόνια να είναι στενά συνδεδεμένα με τον πυρήνα. Όσο πιο μακριά είναι τα ηλεκτρόνια από τον πυρήνα, τόσο πιο αντιδραστικά γίνονται.
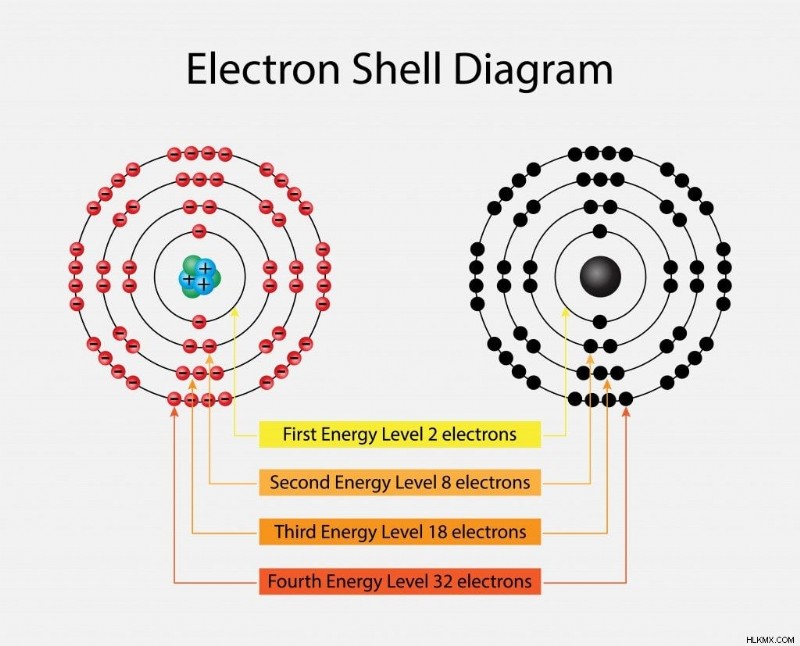
Ενεργειακά επίπεδα ατομικών τροχιακών (Photo Credit :Nasky/ Shutterstock)
Τώρα, μπορεί κανείς να σκεφτεί:γιατί να μην προσαρμόσουμε όλα αυτά τα ηλεκτρόνια σε ένα κέλυφος και να κάνουμε τη χημεία λίγο πιο εύκολη; ! Λοιπόν, ένας άλλος επιστήμονας, ο Wolfgang Pauli, είχε πιθανώς τις ίδιες αμφιβολίες, κάτι που οδήγησε στην ανακάλυψη ενός ενδιαφέροντος γεγονότος σχετικά με τη συμπεριφορά των ηλεκτρονίων.
Ο Pauli παρουσιάστηκε με την Αρχή Αποκλεισμού Pauli το 1925, επιβεβαιώνοντας ότι δύο ηλεκτρόνια δεν μπορούν να καταλάβουν το ίδιο τροχιακό και ότι το ίδιο τροχιακό πρέπει να έχει αντίθετα σπιν. Εν ολίγοις, ένα κέλυφος έχει υποκελύφη και κάθε υποκέλυφος αποτελείται από ένα ή περισσότερα ατομικά τροχιακά. Κάθε τροχιακό μπορεί να κρατήσει μόνο 2 ηλεκτρόνια, το καθένα με αντίθετο σπιν.
Τι είναι τα δευτερεύοντα κελύφη και τα τροχιακά;
Τα κελύφη είναι μια συλλογή από δευτερεύοντα κελύφη που έχουν τον ίδιο κύριο κβαντικό αριθμό (n ). Τα δευτερεύοντα κελύφη είναι μια ομάδα τροχιακών που μοιράζονται τον ίδιο κύριο κβαντικό αριθμό (n ) και αζιμουθιακός κβαντικός αριθμός (ℓ ), ο δεύτερος από τους τέσσερις κβαντικούς αριθμούς. Οι τιμές του ℓ (0,1,2,3) αντιστοιχούν στα s, p, d, και f ετικέτες σε ένα κέλυφος ηλεκτρονίων, αντίστοιχα. ℓ μπορεί να πάρει μια τιμή από 0 έως n -1, και κάθε τροχιακό σε ένα συγκεκριμένο υποκέλυφος έχει 2ℓ + 1 υποκαταστάσεις.
Όταν n=1, ℓ =0 και αντιστοιχεί στο s τροχιακό, το οποίο έχει μόνο 1 υποκατάσταση [2(0) +1=2]; ℓ =1 είναι το p τροχιακό με 3 υποκαταστάσεις (px, py, pz). ℓ =2 είναι d με 5 υποκαταστασεις? και ℓ= Το 3 είναι f τροχιακό με 7 υποκαταστάσεις. Κάθε τροχιακό έχει διαφορετικό σχήμα. Τα s το τροχιακό είναι σφαιρικό, p είναι σε σχήμα αλτήρα, d είναι τριφυλλόφυλλο με ένα μοναδικό σχήμα και f είναι μια πιο σύνθετη έκδοση του d τροχιάς. Επίσης, κάθε τροχιακό μπορεί να κρατήσει μόνο 2 ηλεκτρόνια που περιστρέφονται σε αντίθετες κατευθύνσεις. Μόνο τα τροχιακά s και p εμπλέκονται στον κανόνα της οκτάδας.
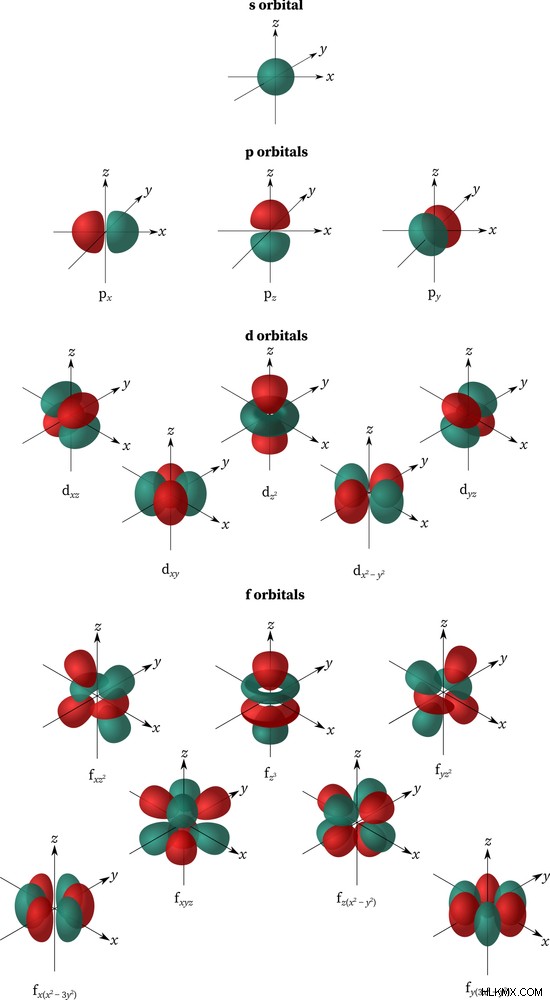
Σχήματα ατομικών τροχιακών (Photo Credit :chemistrygod/Shutterstock)
Ας εξετάσουμε ένα άτομο νατρίου (11), το οποίο έχει συνολικά 11 ηλεκτρόνια. Εάν υπολογίσετε την κατανομή των ηλεκτρονίων με βάση τις παραπάνω πληροφορίες, θα δείτε ότι το νάτριο έχει 3 φλοιούς. ο πρώτος φλοιός θα περιέχει 2 ηλεκτρόνια και ο δεύτερος θα έχει 8, αφήνοντάς μας με 1 μόνο ηλεκτρόνιο στον 3ο φλοιό.
Η ηλεκτρονική διαμόρφωση είναι 2, 8, 1. Το πρώτο κέλυφος έχει μόνο 1 τροχιακό (n=1 και l=0) και φιλοξενεί 2 ηλεκτρόνια. Το δεύτερο κέλυφος έχει 8 ηλεκτρόνια και 2 τροχιακά. Τα πρώτα 2 ηλεκτρόνια αποτελούν μέρος των s τροχιακό και τα άλλα 6 του p τροχιακό (n=2 και l=1). Το τελευταίο ηλεκτρόνιο θα πάει στο 3ο κέλυφος και θα είναι πάλι μέρος του τροχιακού s. Η ηλεκτρονική διαμόρφωση θα είναι τότε:
1s2 2s2 2p6 3s1
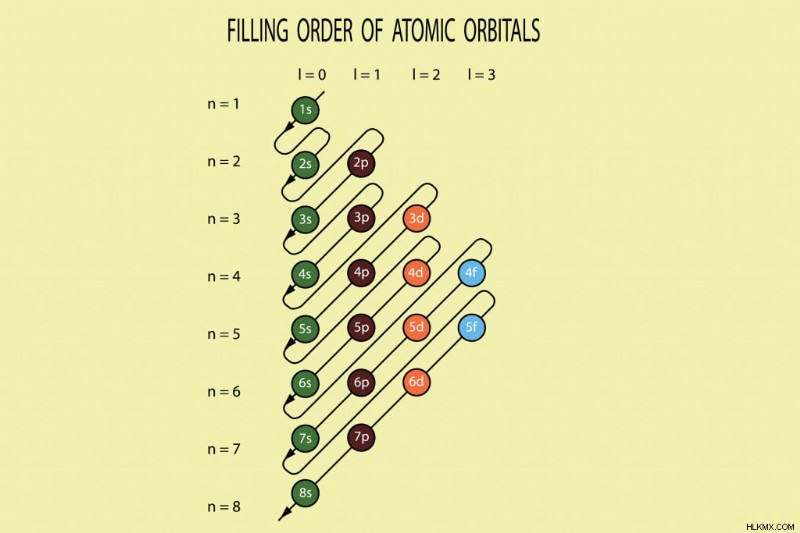
Η σειρά πλήρωσης των ηλεκτρονίων στα τροχιακά ενός ατόμου. Τα χαμηλότερα επίπεδα ενέργειας γεμίζονται πρώτα. (Photo Credit :Amalakanti Satya Sarada/Shutterstock)
Το μοναδικό ηλεκτρόνιο στο 3ο κέλυφος είναι αυτό που κάνει το άτομο νατρίου ασταθές και αντιδραστικό. Λόγω του ατελούς αριθμού ηλεκτρονίων στο κέλυφος σθένους, το νάτριο είναι γνωστό ότι έχει ανοιχτό κέλυφος. Για να αποκτήσουν σταθερότητα, τα ηλεκτρόνια στο τελευταίο τροχιακό σχηματίζουν ομοιοπολικούς ή ιοντικούς δεσμούς με άλλα. Αυτός ο δεσμός αφήνει και τα δύο άτομα με 8 ηλεκτρόνια στο τελευταίο τους περίβλημα και ένα πιο σταθερό μόριο.
Το νάτριο προσπαθεί να αποκτήσει μια κατάσταση όπως το ευγενές αέριο που βρίσκεται πιο κοντά του, το Νέον. Το κέλυφος σθένους του Νέον είναι πλήρες με 8 ηλεκτρόνια και έχει κλειστό κέλυφος. Η ηλεκτρονική διαμόρφωση είναι:
Νέον (10):2,8 ή 1s22s22p6
Τα περισσότερα άλλα στοιχεία προσπαθούν να σχηματίσουν ομοιοπολικούς ή ιοντικούς δεσμούς για να φτάσουν σε κατάσταση παρόμοια με το πλησιέστερο ευγενές αέριο. Μερικές από τις ηλεκτρονικές διαμορφώσεις των ευγενών αερίων είναι οι εξής:
Αργό (18):1s22s22p63s23p6
Krypton (36):1s22s22p63s23p6 3d¹0 4s² 4p⁶
Λεζάντα:Ηλεκτρονικές διαμορφώσεις ευγενών αερίων.
Κάθε κέλυφος είναι πλήρες, κάθε τροχιακό είναι γεμάτο με τον σωστό αριθμό ηλεκτρονίων, και ως αποτέλεσμα, τα ευγενή στοιχεία είναι πολύ σταθερά. Δεν υπάρχει πιθανότητα άλλο μόριο να αλληλεπιδράσει μαζί τους, καθώς δεν έχουν τίποτα να προσφέρουν. Φανταστείτε ότι είστε σχοινοβάτης και έχετε ένα μπαστούνι στα χέρια σας για ισορροπία. Δεν θα θέλατε να παρατήσετε το μπαστούνι επειδή φοβάστε ότι μπορεί να πέσετε. Ταυτόχρονα, δεν θα θέλατε άλλο άτομο να σας βοηθήσει, γιατί μπορεί να επηρεάσει την ισορροπία σας. Ομοίως, τα ευγενή στοιχεία είναι τόσο σταθερά που δεν υπάρχει ανάγκη να αποκτήσουν ή να χάσουν ηλεκτρόνια.
Εξαιρέσεις στον κανόνα της Οκτάδας
Ο Gilbert Lewis γνώριζε ότι ο κανόνας της οκτάδας δεν μπορούσε να εφαρμοστεί καθολικά σε όλα τα στοιχεία. Το 1916, ο αριθμός των μορίων που ανακαλύφθηκαν ήταν σημαντικά μικρότερος, και ως αποτέλεσμα, ο κανόνας της οκτάδας θεωρήθηκε ως κανόνας της φύσης. Με τα χρόνια, αυτός ο κανόνας εδραιώθηκε τόσο πολύ στο μυαλό των ανθρώπων που ήταν δύσκολο να αποδεχτεί κανείς ότι οι εξαιρέσεις στον κανόνα υπερτερούν των περιλήψεων!

Ο περιοδικός πίνακας (Photo Credit :julie deshaies/Shutterstock)
Όπως αποδεικνύεται, μόνο στοιχεία που ανήκουν στην Κύρια Ομάδα (Ομάδα 1, 2, 14-18 ) του Περιοδικού πίνακα ακολουθούν τον κανόνα της οκτάδας, αφήνοντας έξω ένα τεράστιο κομμάτι άλλων ουσιών. Οι γενικές εξαιρέσεις περιλαμβάνουν εκείνα τα μόρια που έχουν περιττό αριθμό ηλεκτρονίων και εκείνα στα οποία τα άτομα διαθέτουν περισσότερα από ή λιγότερα από 8 ηλεκτρόνια.
Συμπέρασμα
Ο κανόνας της οκτάδας είναι καθοριστικός για τον προσδιορισμό της αντιδραστικής φύσης των ατόμων. Το αν ένα άτομο σχηματίζει ομοιοπολικούς ή ιοντικούς δεσμούς μπορεί να προσδιοριστεί από τις δομές κουκίδων Lewis Electron. Τα άτομα αναζητούν συνεχώς σταθερότητα και επομένως σχηματίζουν χημικούς δεσμούς για να έχουν μια ηλεκτρονική διαμόρφωση παρόμοια με τα ευγενή στοιχεία. Αν και ο κανόνας της οκτάδας δεν είναι καθολικά εφαρμόσιμος για όλα τα στοιχεία, αποτελεί τη βάση της κατανόησής μας για τη χημεία!