Διαφορά μεταξύ Τοποχημείας και Στερεοχημείας
Κύρια διαφορά – Τοποχημεία έναντι Στερεοχημείας
Η Τοποχημεία και η στερεοχημεία είναι δύο συγκεκριμένοι κλάδοι της χημείας. Τοποχημεία είναι η χημεία των τοποεκλεκτικών αντιδράσεων. Είναι ένας όρος που περιγράφει πώς λαμβάνει χώρα μια χημική αντίδραση. Τοποεπιλεκτικότητα είναι η προτίμηση μιας κατεύθυνσης δημιουργίας ή θραύσης χημικού δεσμού έναντι όλων των άλλων πιθανών κατευθύνσεων. Η στερεοχημεία, από την άλλη πλευρά, είναι ένας κλάδος της χημείας που περιλαμβάνει τη μελέτη των χωρικών διατάξεων των οργανικών μορίων. Η στερεοχημεία περιγράφει τη διάταξη των στερεοϊσομερών. Η κύρια διαφορά μεταξύ της τοποχημείας και της στερεοχημείας είναι ότι η τοποχημεία περιγράφει την ατομική διάταξη του τελικού προϊόντος μιας χημικής αντίδρασης, ενώ η στερεοχημεία περιγράφει την ατομική διάταξη των μορίων και τον χειρισμό τους.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το Regiochemistry
– Ορισμός, ο κανόνας του Markovnikov και ο κανόνας του Anti Markovnikov
2. Τι είναι η Στερεοχημεία
– Ορισμός, Στερεοϊσομερή, Γεωμετρικά Ισομερή, Οπτικά Ισομερή, Χειρικότητα
3. Ποια είναι η διαφορά μεταξύ Τοποχημείας και Στερεοχημείας
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Ισομερή Cis, Γεωμετρικά Ισομερή, Ισομερή, Τοποχημεία, Τοποεπιλεκτικότητα, Στερεοχημεία, Στερεοϊσομερή, Trans Ισομερή

Τι είναι η Regiochemistry
Η Τοποχημεία είναι ο κλάδος της χημείας που εξηγεί την τοποεπιλεκτικότητα των χημικών αντιδράσεων. Τοποεπιλεκτικότητα είναι η προτίμηση για έναν προσανατολισμό έναντι όλων των άλλων πιθανών προσανατολισμών στη διάταξη ενός προϊόντος αντίδρασης.
Η τοποχημεία υποδεικνύει ποιο προϊόν είναι το κύριο προϊόν και ποιο είναι το δευτερεύον προϊόν σε μια χημική αντίδραση που δίνει πολλά προϊόντα. Αυτό εξαρτάται από τις πιθανές θέσεις του μορίου στόχου στο οποίο πρόκειται να προστεθούν τα μόρια του αντιδραστηρίου. Για παράδειγμα, σε έναν υποκατεστημένο δακτύλιο βενζολίου, το μόριο του αντιδραστηρίου μπορεί να συνδεθεί σε μία από τις τρεις πιθανές θέσεις, ortho , παρά και μετα θέσεις, ανάλογα με τον υποκαταστάτη που υπάρχει ήδη στον δακτύλιο βενζολίου.
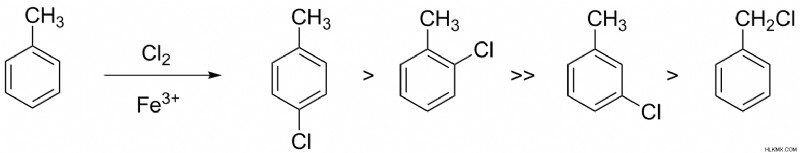
Εικόνα 1:Η χλωρίωση με τολουόλιο είναι τοποεκλεκτική
Η παραπάνω αντίδραση δείχνει τη χλωρίωση του τολουολίου. Υπάρχουν πολλές πιθανές θέσεις για το άτομο χλωρίου να προσκολληθεί στο μόριο του τολουολίου. Αλλά η αντικατάσταση παρα είναι η πιο σταθερή από όλες. Επομένως είναι το κύριο προϊόν που δίνεται από αυτή την αντίδραση.
Έχουν εισαχθεί αρκετοί κανόνες προκειμένου να καθοριστεί ποιο θα ήταν το κύριο προϊόν μιας συγκεκριμένης χημικής αντίδρασης. Ο πρώτος κανόνας είναι ο κανόνας του Markovnikov. Σύμφωνα με τον κανόνα Markovnikov, το πρωτόνιο προστίθεται στο άτομο άνθρακα που έχει τον μεγαλύτερο αριθμό ατόμων υδρογόνου συνδεδεμένα σε αυτό, καθώς και αντιδράσεις προσθήκης αλκενίων ή αλκυνίων. Αυτός ο κανόνας βοηθά στην πρόβλεψη του τελικού προϊόντος μιας συγκεκριμένης χημικής αντίδρασης.
Ωστόσο, σύμφωνα με τον κανόνα Anti Markovnikov, ο οποίος εισήχθη αργότερα, επιπλέον αντιδράσεις αλκενίων ή αλκυνίων, το πρωτόνιο προστίθεται στο άτομο άνθρακα που έχει τον μικρότερο αριθμό ατόμων υδρογόνου προσκολλημένο σε αυτό. Το τελικό προϊόν που λαμβάνεται από αυτή την αντίδραση ονομάζεται προϊόν Anti Markovnikov. Αυτός ο μηχανισμός δεν περιλαμβάνει το σχηματισμό ενός ενδιάμεσου καρβοκατιόντος. Οι χημικές αντιδράσεις μπορούν να μετατραπούν σε αντιδράσεις που δίνουν το προϊόν Anti Markovnikov προσθέτοντας ένα υπεροξείδιο όπως το HOOH στο μείγμα της αντίδρασης.
Μερικοί άλλοι κανόνες σχετικά με την Τοποχημεία περιλαμβάνουν τον κανόνα Fürst-Plattner για τις αντιδράσεις προσθήκης πυρηνόφιλων, τον κανόνα του Baldwin για την Τοποεπιλεκτικότητα των αντιδράσεων κλεισίματος δακτυλίου κ.λπ.
Τι είναι η Στερεοχημεία
Η στερεοχημεία είναι ένας κλάδος της χημείας που περιλαμβάνει τη μελέτη των χωρικών διατάξεων των οργανικών μορίων και τον χειρισμό τους. Περιλαμβάνει τη μελέτη των στερεοϊσομερών. Τα στερεοϊσομερή είναι μόρια που έχουν τον ίδιο μοριακό τύπο και την ατομική διάταξη, αλλά διαφορετικές χωρικές διατάξεις. Οι δύο κύριες ομάδες στερεοϊσομερών είναι:
- Γεωμετρικά ισομερή
- Οπτικά ισομερή
Τα γεωμετρικά ισομερή είναι επίσης γνωστά ως cis-trans ισομερή. Αυτά τα ισομερή εμφανίζονται πάντα σε ζεύγη. Τα δύο ισομερή είναι το cis-ισομερές και το trans-ισομερές. Αυτά τα ισομερή απαντώνται σε μόρια που έχουν διπλούς δεσμούς. Η σύνδεση μιας λειτουργικής ομάδας στο βινυλικό άτομο άνθρακα είναι η διαφορά μεταξύ αυτών των δύο ισομερών. (Ο βινυλικός άνθρακας είναι το άτομο άνθρακα που έχει διπλό δεσμό με ένα άλλο άτομο άνθρακα.)
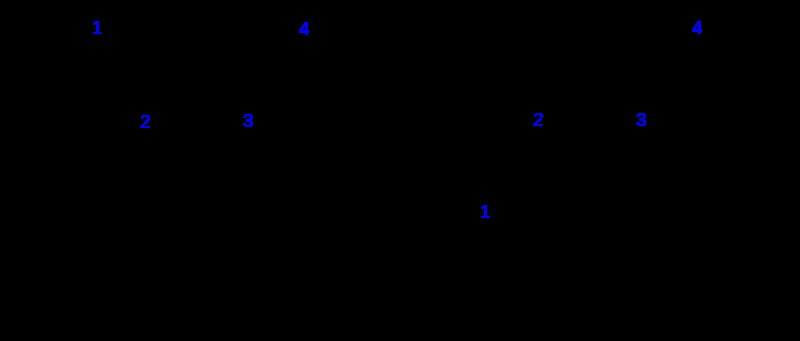
Εικόνα 2:Γεωμετρικός ισομερισμός
Επιπλέον, η στερεοχημεία περιγράφει επίσης την έννοια της χειραλικότητας. Η χειρομορφία είναι η ιδιότητα ενός μορίου που λέει ότι η κατοπτρική εικόνα του δεν μπορεί να υπερτεθεί με το μόριο. Ένας χειρόμορφος άνθρακας είναι ένας ασύμμετρος άνθρακας. Ένα άτομο άνθρακα μπορεί να έχει το πολύ τέσσερις δεσμούς. Ο χειρόμορφος άνθρακας συνδέεται με τέσσερις διαφορετικές ομάδες και είναι ασύμμετρος. Το άτομο άνθρακα θα πρέπει πάντα να υβριδοποιείται sp για να είναι ένας χειρόμορφος άνθρακας. Ένα χειρόμορφο μόριο κανονικά περιέχει τουλάχιστον έναν χειρόμορφο άνθρακα. Τα υβριδισμένα άτομα άνθρακα sp ή sp2 δεν μπορούν να είναι χειρόμορφα επειδή δεν μπορούν να έχουν τέσσερις διαφορετικές ομάδες γύρω τους λόγω της παρουσίας π-δεσμών. Τα οπτικά ισομερή εμφανίζονται σε μόρια με χειρόμορφο άνθρακα. Αυτός ο χειρόμορφος άνθρακας προκαλεί την εμφάνιση ενός στερεοϊσομερούς, το οποίο είναι η μη υπερτιθέμενη κατοπτρική εικόνα αυτού του μορίου.
Διαφορά μεταξύ Τοποχημείας και Στερεοχημείας
Ορισμός
Τοποχημεία: Τοποχημεία είναι ο κλάδος της χημείας που εξηγεί την τοποεπιλεκτικότητα των χημικών αντιδράσεων.
Στερεοχημεία: Η στερεοχημεία είναι ένας κλάδος της χημείας που περιλαμβάνει τη μελέτη των χωρικών διατάξεων των οργανικών μορίων και τον χειρισμό τους.
Εστίαση
Τοποχημεία: Το Regiochemistry εξηγεί τους κανόνες που χρησιμοποιούνται για τον προσδιορισμό των τελικών προϊόντων ορισμένων χημικών αντιδράσεων.
Στερεοχημεία: Η στερεοχημεία εξηγεί τις ατομικές διατάξεις διαφορετικών στερεοϊσομερών.
Προδιαγραφές
Τοποχημεία: Η τοποχημεία περιλαμβάνει σημαντικούς κανόνες όπως ο κανόνας Markovnikov, ο κανόνας Anti Markovnikov, ο κανόνας Fürst-Plattner, ο κανόνας του Baldwin κ.λπ.
Στερεοχημεία: Η στερεοχημεία περιλαμβάνει γεωμετρικά ισομερή, οπτικά ισομερή και χειραλικότητα των μορίων.
Συμπέρασμα
Η Τοποχημεία και η στερεοχημεία είναι δύο σημαντικές υποκατηγορίες της χημείας. Η κύρια διαφορά μεταξύ τοποχημείας και στερεοχημείας είναι ότι η τοποχημεία περιγράφει την ατομική διάταξη του τελικού προϊόντος μιας χημικής αντίδρασης, ενώ η στερεοχημεία περιγράφει την ατομική διάταξη των μορίων και τον χειρισμό τους.
Αναφορά:
1. «Τοπική επιλεκτικότητα». Wikipedia, Ίδρυμα Wikimedia, 13 Ιανουαρίου 2018, Διαθέσιμο εδώ.
Εικόνα Ευγενική προσφορά:
1. «Χλωρίωση τολουολίου με γεωεπιλεκτικότητα» Από τον Mfomich – Δική μου εργασία (CC0) μέσω Commons Wikimedia
2. "Παράδειγμα Cis-trans" Από JaGa – Αυτοκατασκευασμένο με χρήση BKChem και Inkscape (CC BY-SA 3.0) μέσω Commons Wikimedia




