Διαφορά μεταξύ χλωριούχου νατρίου και ιωδιούχου νατρίου
Κύρια διαφορά – Χλωριούχο νάτριο έναντι Ιωδιούχου Νατρίου
Το νάτριο είναι ένα χημικό στοιχείο με ατομικό αριθμό 11 και χημικό σύμβολο "Na". Αυτό το σύμβολο προέρχεται από τη λατινική λέξη "Natrium" για το ανθρακικό νάτριο. Το νάτριο σχηματίζει έναν αριθμό ενώσεων που είναι πολύ χρήσιμες σε εργαστήρια καθώς και σε βιομηχανίες. Τα άλατα του νατρίου είναι αλκαλικά. Το χλωριούχο νάτριο και το ιωδιούχο νάτριο είναι δύο ενώσεις αλογονιδίου του νατρίου. Τα αλογονίδια είναι ανιόντα που σχηματίζονται από τα στοιχεία της ομάδας 7. Η κύρια διαφορά μεταξύ του χλωριούχου νατρίου και του ιωδιούχου νατρίου είναι ότι το χλωριούχο νάτριο αποτελείται από ένα ιόν χλωρίου συνδεδεμένο με ένα ιόν νατρίου ενώ το ιωδιούχο νάτριο αποτελείται από ένα ιόν ιωδίου συνδεδεμένο με ένα ιόν νατρίου.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το χλωριούχο νάτριο
– Ορισμός, Δομή, Ιδιότητες
2. Τι είναι το ιωδιούχο νάτριο
– Ορισμός, Δομή, Ιδιότητες
3. Ποιες είναι οι ομοιότητες μεταξύ του χλωριούχου νατρίου και του ιωδιούχου νατρίου
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ του χλωριούχου νατρίου και του ιωδιούχου νατρίου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:ανιόν, κατιόν, αλογονίδιο, νάτριο, χλωριούχο νάτριο, αλογονίδιο νατρίου, ιωδιούχο νάτριο

Τι είναι το χλωριούχο νάτριο
Το χλωριούχο νάτριο είναι μια ανόργανη ένωση που αποτελείται από κατιόν νατρίου και χλωριούχο ανιόν. Είναι κοινώς γνωστό ως αλάτι, καθώς το αλάτι που καταναλώνουμε ως πρόσθετο τροφίμων αποτελείται κυρίως από χλωριούχο νάτριο μαζί με ορισμένες ιχνοστοιχεία (χλωριούχο νάτριο περίπου 99,8% στο αλάτι). Ο χημικός τύπος του χλωριούχου νατρίου είναι NaCl.
Το χλωριούχο νάτριο είναι μια ιοντική ένωση. Έχει 1:1 ιόντα νατρίου και ιόντα χλωρίου. Το χλωριούχο νάτριο είναι η ένωση που ευθύνεται για τη χαρακτηριστική γεύση στο θαλασσινό νερό. Το βάρος του τύπου του χλωριούχου νατρίου είναι 58,44 g/mol. Το χλωριούχο νάτριο είναι λευκό όταν είναι καθαρό. Εμφανίζεται ως διαφανείς ή ημιδιαφανείς κυβικοί κρύσταλλοι. Το σημείο τήξης του χλωριούχου νατρίου είναι 801 C και το σημείο βρασμού είναι 1465 C. Είναι καλά διαλυτό στο νερό. Στην κρυσταλλική δομή του χλωριούχου νατρίου, κάθε ιόν περιβάλλεται από έξι ιόντα αντίθετου φορτίου. Αυτά τα ιόντα βρίσκονται σε μια κανονική δομή οκταέδρων.
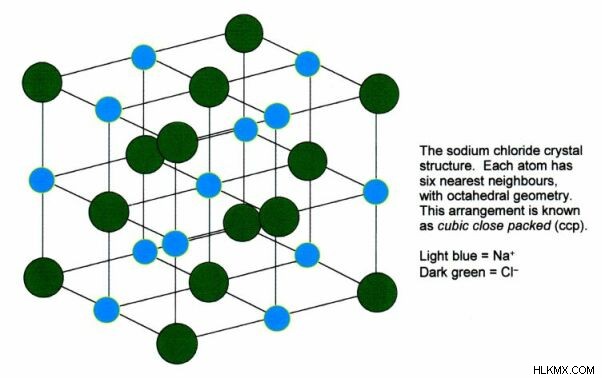
Εικόνα 1:Κρυσταλλική δομή χλωριούχου νατρίου
Το χλωριούχο νάτριο είναι υγροσκοπικό. Αυτό σημαίνει ότι μπορεί να απορροφήσει υδρατμούς από τον αέρα όταν εκτίθεται στην ατμόσφαιρα. Αυτή η ένωση είναι απαραίτητη για να διατηρήσουμε την ηλεκτρολυτική ισορροπία στο σώμα μας. Χρησιμοποιείται επίσης για τη συντήρηση ορισμένων τροφίμων.
Τι είναι το ιωδιούχο νάτριο
Το ιωδιούχο νάτριο είναι μια ανόργανη χημική ένωση που αποτελείται από ιόντα νατρίου και ιόντα ιωδίου. Ο χημικός τύπος αυτής της ένωσης είναι NaI. Είναι μια ιοντική ένωση. Έχει λευκό χρώμα και είναι υδατοδιαλυτή ένωση.
Η μάζα του τύπου ιωδιούχου νατρίου είναι 149,89 g/mol. Η ένωση περιέχει κατιόντα νατρίου και ανιόντα ιωδίου. Επομένως, είναι μια ένωση αλογονιδίου του νατρίου. Αυτή η ένωση μπορεί να παραχθεί βιομηχανικά με την αντίδραση μεταξύ υδροξειδίου του νατρίου και υδροϊωδικού οξέος.
NaOH + HI → NaI + H2 Ον
Το σημείο τήξης του ιωδιούχου νατρίου είναι 651 °C και το σημείο βρασμού είναι 1304 °C. Το ιωδιούχο νάτριο είναι μια υγρή στερεή ένωση. Αυτό σημαίνει ότι μπορεί να απορροφήσει υδρατμούς από την ατμόσφαιρα και να μετατραπεί σε διάλυμα. Η στερεά ένωση αποκτά ένα καφέ χρώμα όταν εκτίθεται στον αέρα ή το φως, λόγω του σχηματισμού αναθυμιάσεων ιωδίου.
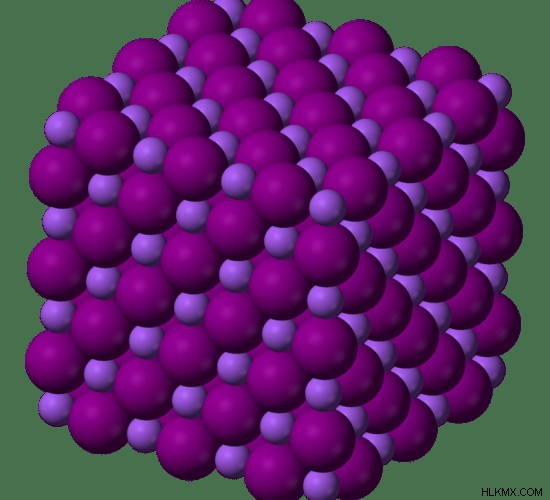
Εικόνα 2:Κρυσταλλική δομή ιωδιούχου νατρίου
Το ιωδιούχο νάτριο χρησιμοποιείται ως συμπλήρωμα ιωδίου. Αναμιγνύεται με χλωριούχο νάτριο κατά την παραγωγή αλατιού. Επομένως, αυτό που καταναλώνουμε ως αλάτι είναι ένα συμπλήρωμα ιωδίου που βοηθά στην αποφυγή της ανεπάρκειας ιωδίου.
Ομοιότητες μεταξύ χλωριούχου νατρίου και ιωδιούχου νατρίου
- Και οι δύο ενώσεις είναι αλογονίδια νατρίου.
- Και τα δύο μπορούν να απορροφήσουν υδρατμούς.
- Και τα δύο αποτελούνται από κατιόντα νατρίου.
- Και τα δύο είναι λευκά
- Και τα δύο έχουν κρυσταλλική δομή.
Διαφορά μεταξύ χλωριούχου νατρίου και ιωδιούχου νατρίου
Ορισμός
Χλωριούχο νάτριο: Το χλωριούχο νάτριο είναι μια ανόργανη ένωση που αποτελείται από κατιόν νατρίου και ανιόν χλωρίου.
Ιωδιούχο νάτριο: Το ιωδιούχο νάτριο είναι μια ανόργανη χημική ένωση που αποτελείται από ιόντα νατρίου και ιόντα ιωδιδίου.
Χημικός τύπος
Χλωριούχο νάτριο: Ο χημικός τύπος του χλωριούχου νατρίου είναι NaCl.
Ιωδιούχο νάτριο: Ο χημικός τύπος του ιωδιούχου νατρίου είναι NaI.
Μάζα τύπου
Χλωριούχο νάτριο: Η μάζα του τύπου χλωριούχου νατρίου είναι 58,44 g/mol.
Ιωδιούχο νάτριο: Η μάζα του τύπου του ιωδιούχου νατρίου είναι 149,89 g/mol.
Σημείο τήξης και σημείο βρασμού
Χλωριούχο νάτριο: Το σημείο τήξης του χλωριούχου νατρίου είναι 801°C και το σημείο βρασμού είναι 1465°C.
Ιωδιούχο νάτριο: Το σημείο τήξης του ιωδιούχου νατρίου είναι 651°C και το σημείο βρασμού είναι 1304°C.
Φύση της ένωσης
Χλωριούχο νάτριο: Το χλωριούχο νάτριο είναι υγροσκοπικό.
Ιωδιούχο νάτριο: Το ιωδιούχο νάτριο είναι υγρό.
Συμπέρασμα
Το νάτριο μπορεί να σχηματίσει πολλές διαφορετικές ενώσεις. Το χλωριούχο νάτριο και το ιωδιούχο νάτριο είναι δύο τέτοιες ενώσεις που είναι αλογονίδια νατρίου. Η κύρια διαφορά μεταξύ του χλωριούχου νατρίου και του ιωδιούχου νατρίου είναι ότι το χλωριούχο νάτριο αποτελείται από ένα ιόν χλωρίου συνδεδεμένο με ένα ιόν νατρίου, ενώ το ιωδιούχο νάτριο αποτελείται από ένα ιόν ιωδίου συνδεδεμένο με ένα ιόν νατρίου.




