Κανόνες Ονομασίας Οξέος
Βασικές έννοιες
Σε αυτό το άρθρο, θα μάθετε τους βασικούς ορισμούς του τι αποτελείται από ένα οξύ, καθώς και τους κανόνες ονομασίας οξέων . Θα μάθετε επίσης πώς τα ισχυρά και τα αδύναμα οξέα διαχωρίζονται στο νερό.
Θέματα που καλύπτονται σε άλλα άρθρα
- KSP – Σταθερά προϊόντος διαλυτότητας
- Μονοπρωτικά, τριπρωτικά και πολυπρωτικά οξέα
- Τι είναι η διαλυτότητα;
- Κανόνες διαλυτότητας και γραφήματα
- Τι είναι η σταθερά ισορροπίας;
Τι είναι ένα οξύ;
Ένα οξύ είναι ένα μόριο ή ιόν ικανό να δώσει ένα πρωτόνιο, γνωστό ως οξύ Brønsted–Lowry. Ένα οξύ μπορεί επίσης να οριστεί ως ένα μόριο που σχηματίζει έναν ομοιοπολικό δεσμό με ένα ζεύγος ηλεκτρονίων, γνωστό ως οξύ Lewis. Τα οξέα θα είναι πάντα ιόντα ή μόρια. Πώς είναι ένα οξύ ένα μόριο; Λοιπόν, όλα τα οξέα αποτελούνται από μη μέταλλα και ένα μόριο είναι απλώς ένα άλλο όνομα για έναν ομοιοπολικό δεσμό. Τα ιόντα υδρογόνου (γνωστά και ως πρωτόνια επειδή το υδρογόνο περιέχει μόνο ένα πρωτόνιο), είναι ένα βασικό στοιχείο για το τι είναι ένα οξύ. Ένας άλλος καλός τρόπος για να αναγνωρίσετε τα οξέα είναι να αναζητήσετε το σύμβολο (aq) στις χημικές εξισώσεις. Αυτό υποδηλώνει ότι το διάλυμα είναι υδατικό, που σημαίνει ότι θα διαλυθεί σε νερό. Εάν ένα από τα είδη που θα είναι υδατικό είναι Η, τότε αυτό είναι ένδειξη ενός οξέος.
Οι περισσότεροι από εμάς έχουμε ακούσει για οξέα στο παρελθόν, αλλά τι ταξινομεί ένα οξύ ως ισχυρό ή αδύναμο; Εάν το άτομο υδρογόνου αποσυνδεθεί πλήρως ή μόνο μερικώς, καθορίζει εάν το οξύ είναι ισχυρό ή αδύναμο. Αυτό σημαίνει ότι για ένα ισχυρό οξύ όταν το οξύ τοποθετείται σε ένα ποτήρι με νερό το ιόν υδρογόνου θα βρεθεί 100% αποσπασμένο από το αρχικό του μόριο σε διάλυμα. Υπάρχουν μόνο έξι ισχυρά οξέα:θειικό οξύ, νιτρικό οξύ, υδροχλωρικό οξύ, υδροβρωμικό οξύ, υδροϊωδικό οξύ και υπερχλωρικό οξύ.
Ας χρησιμοποιήσουμε HCl (υδροχλωρικό οξύ) και HF (υδροφθορικό οξύ) ως παραδείγματα.
Χημικός τύπος για το υδροχλωρικό οξύ:HCl(aq) → H(aq) + Cl(aq)
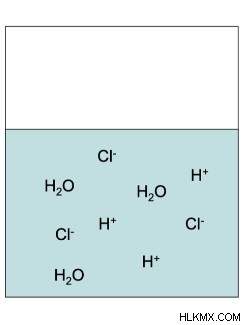
Χημικός τύπος για το υδροφθορικό οξύ:HF(aq) ⇄ H(aq) + F(aq)
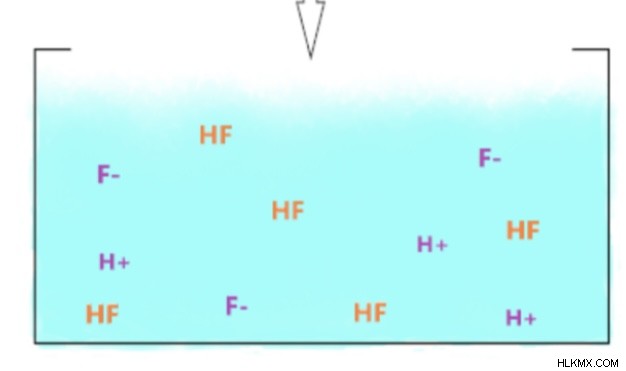
Με βάση τις χημικές εξισώσεις το HCl αποσυνδέεται πλήρως επειδή είναι ισχυρό οξύ. Ωστόσο, το HF έχει βέλη ισορροπίας στην εξίσωσή του επειδή θα υπάρχει άθικτο HF στο διάλυμα καθώς και μόνο το φθόριο και το ιόν υδρογόνου. Το HF θα προσκολληθεί σε ένα μόριο νερού και θα σχηματίσει υδρόνιο που θα κάνει το διάλυμα βασικό.
Πώς να ονομάσετε οξέα
Ονομασία οξέων με οξυγόνο
Παράδειγμα νούμερο ένα νιτρικό οξύ-
- Πρώτον – Προσδιορίστε το πολυατομικό ανιόν HΟΧΙ3 → ΟΧΙ3 συνειδητοποιήστε ότι αυτό είναι νιτρικό
- Δεύτερον – Γράψτε το όνομα του πολυατομικού ιόντος NO3 =Νιτρικό
- Τρίτο – Αλλάξτε το επίθημα -ate σε -ic Nitrate → Νιτρικό
- Τέταρτον – Προσθέστε τη λέξη οξύ στο όνομα (Νιτρικό οξύ)
Παράδειγμα νούμερο δύο θειικό οξύ-
- Πρώτον – Προσδιορίστε το πολυατομικό ανιόν HSO3 → SO3 συνειδητοποιήστε ότι αυτό είναι θειώδες
- Δεύτερο – Γράψτε το όνομα του πολυατομικού ιόντος SO3 =Θειώδες
- Τρίτο – Αλλάξτε το επίθημα -ite σε -ous Sulfite → Θειούχο
- Τέταρτον – Προσθέστε τη λέξη οξύ στο όνομα (Sulfurous Acid)
(Η ορθογραφία του φωσφορικού αλλάζει επίσης σε φωσφορή ic acid για να ακούγεται καλύτερα)
Είναι καλή ιδέα να απομνημονεύσετε τη λίστα των κοινών πολυατομικών ιόντων επειδή τα οξέα που περιέχουν οξυγόνο έχουν αυτά τα πολυατομικά ανιόντα μέσα τους.
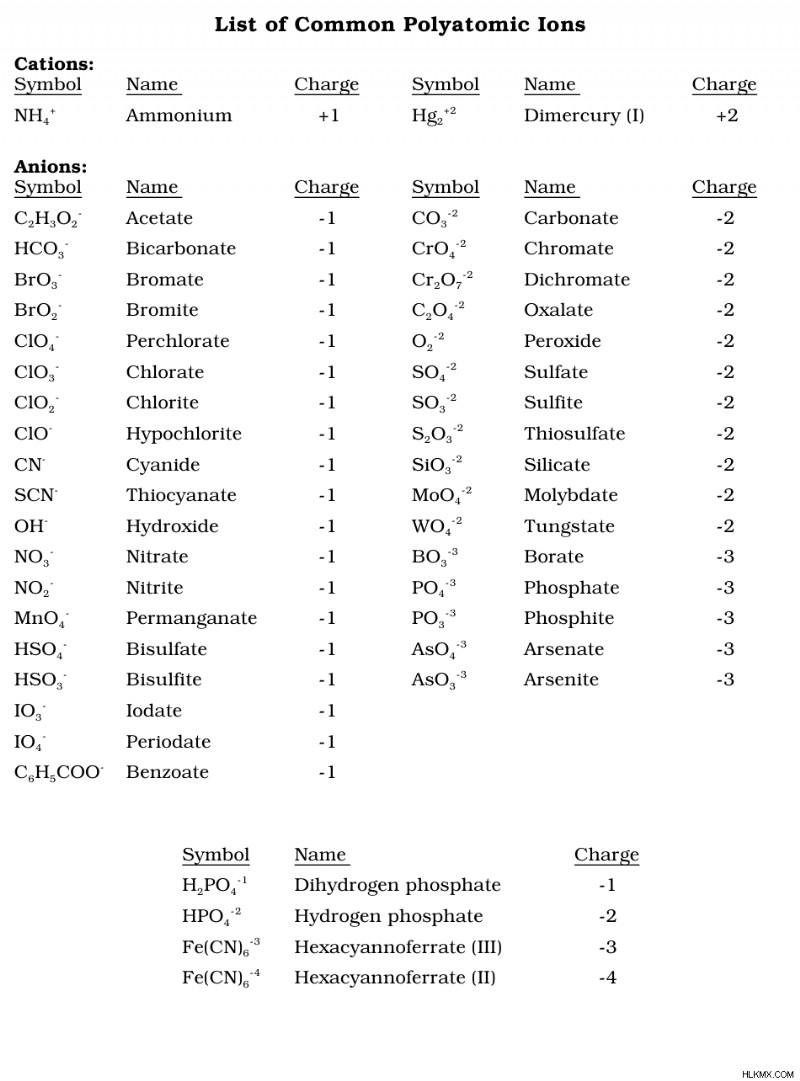
Για να συνοψίσουμε τους κανόνες ονομασίας οξέος για οξέα με οξυγόνο, τα πολυατομικά ανιόντα που τελειώνουν σε -ate γίνονται είναι -ic acids. Πολυατομικά ανιόντα που καταλήγουν σε -ite γίνονται τα -ous οξέα
Γράψιμο των χημικών τύπων για οξέα με οξυγόνο
Παράδειγμα νούμερο ένα Χλωρικό Οξύ-
- Πρώτα – γράψτε το σύμβολο για το κατιόν υδρογόνου – H =ιόν υδρογόνου
- Δεύτερο – Προσδιορίστε το πολυατομικό ανιόν στο όνομα του οξέος αντικαθιστώντας το επίθημα -ic με το επίθημα -ate Chloric Οξύ → Χλωρικό
- Τρίτον – γράψτε τον χημικό τύπο για το πολυατομικό ανιόν Χλωρικό =ClO3
- Τέταρτον – Συνδυάστε τον χημικό τύπο για τοκατιόν υδρογόνου και το πολυατομικό ανιόν H και ClO3 έχουν αναλογία 1:1 1(+1) + 1(-1) =0 . Αυτό σημαίνει ότι οι ενώσεις είναι ουδέτερο HClO3
- Πέμπτον – Γράψτε τον δείκτη (aq) ώστε να γνωρίζουμε ότι η ουσία είναι υδατικό διάλυμα.
Ονομασία οξέων χωρίς οξυγόνο
Παράδειγμα νούμερο ένα HCl –
- Πρώτα – Προσδιορίστε το μονοατομικό ανιόν HCl → Cl
- Δεύτερο – Γράψτε το όνομα του μονατομικού ανιόντος Cl =Χλώριο
- Τρίτο – Αντικαταστήστε το επίθημα -ide στο μονατομικό ανιόν με -ic. Χλώριο → Χλώριο
- Τέταρτον – Προσθέστε το πρόθεμα Hydro και τη λέξη Οξύ . Έτσι, παίρνετε Υδροχλωρικό Οξύ
Παράδειγμα νούμερο δύο H2 Σι –
- Πρώτα – Προσδιορίστε το μονατομικό ανιόν H2 S → S
- Δεύτερο – Γράψτε το όνομα του μονατομικού ανιόντος S =σουλφίδιο
- Τρίτο – Αντικαταστήστε το επίθημα -ide στο μονατομικό ανιόν με -ic. Sulfide → Sulfuric (η ορθογραφία αλλάζει λίγο για να ακούγεται καλύτερα).
- Τέταρτον – Προσθέστε το πρόθεμα Hydro και τη λέξη Οξύ . Έτσι, παίρνετε Υδροθειικό οξύ
(Η ορθογραφία του φωσφόρου αλλάζει επίσης σε φωσφορικό)
Για να συνοψίσουμε τους κανόνες ονομασίας οξέων για οξέα χωρίς οξυγόνο – Η χημική ονομασία των οξέων που δεν περιέχουν οξυγόνο αρχίζει πάντα με το πρόθεμα -hydro και τελειώνει με το επίθημα -ic.