Τι είναι το Δευτέριο; Γεγονότα και χρήσεις

Το δευτέριο είναι το ισότοπο υδρογόνου που έχει ένα πρωτόνιο και ένα νετρόνιο στον ατομικό του πυρήνα. Αντίθετα, το μεγαλύτερο μέρος του υδρογόνου είναι το ισότοπο που ονομάζεται protium, το οποίο έχει ένα πρωτόνιο και όχι νετρόνια. Ακολουθεί μια συλλογή στοιχείων για το δευτέριο, συμπεριλαμβανομένου του αν είναι ραδιενεργό, της ιστορίας του, των χρήσεών του και των πηγών του.
Είναι το δευτέριο ραδιενεργό;
Το δευτέριο, όπως και το πρωτίιο, είναι ένα σταθερό ισότοπο. Με άλλα λόγια, δεν είναι ραδιενεργός. Το μόνο ραδιενεργό ισότοπο υδρογόνου είναι το τρίτιο.
Ιστορικό
Αν και οι επιστήμονες γνώριζαν για σταθερά ισότοπα πριν από την ανακάλυψη του δευτερίου, δεν πίστευαν ότι το υδρογόνο θα μπορούσε να έχει ισότοπα. Ο λόγος είναι ότι το νετρόνιο δεν είχε ακόμη ανακαλυφθεί, έτσι οι ερευνητές θεώρησαν ότι τα ισότοπα διέφεραν ανάλογα με τον αριθμό των πρωτονίων τους και κάτι που αποκαλούσαν πυρηνικά ηλεκτρόνια. Με αυτό το σκεπτικό, το υδρογόνο δεν θα μπορούσε να έχει ισότοπα επειδή ο πυρήνας θα μπορούσε να περιέχει μόνο ένα πρωτόνιο. Έτσι, η ανακάλυψη του δευτερίου (και του τριτίου) προκάλεσε λίγο σοκ και άλλαξε εντελώς την κατανόηση των ισοτόπων.
Ο Harold Urey ανακάλυψε το δευτέριο το 1931. Αυτός και ο συνεργάτης του, Ferdinand Brickwedde, αποστάξανε το ισότοπο από υγρό υδρογόνο χρησιμοποιώντας το εργαστήριο φυσικής χαμηλής θερμοκρασίας στο Εθνικό Γραφείο Προτύπων στην Ουάσιγκτον, DC. Συγκέντρωσαν το ισότοπο αρκετά ώστε η φασματοσκοπία να το έδειξε οριστικά ατομική μάζα 2. Η δουλειά του του χάρισε το Νόμπελ Χημείας το 1934.
Ονομασία
Το στοιχείο υδρογόνο είναι μοναδικό στο ότι κάθε ισότοπό του έχει τα δικά του ονόματα. Το Δευτέριο πήρε το όνομά του από την ελληνική λέξη δευτέρος , που σημαίνει «δεύτερος», σε συνδυασμό με το –ium επίθημα για ένα στοιχείο. Το όνομα αναφέρεται στο δεύτερο νουκλεόνιο στον πυρήνα.
Ο Urey ονόμασε πρωτίου, δευτέριο και τρίτιο. Ως ανακάλυψε τα ισότοπα, αυτό ήταν δικαίωμά του. Ωστόσο, ορισμένοι επιστήμονες αντιστάθηκαν στα ονόματα. Για παράδειγμα, ο Έρνεστ Ράδερφορντ αισθάνθηκε ότι το δευτέριο θα έπρεπε να ονομαστεί «διπλογόνο», από την ελληνική λέξη διπλός ("διπλό"). Ο Ράδερφορντ πρότεινε ο πυρήνας του δευτερίου να ονομάζεται «διπλών» αντί «δευτέρον» ή «δευτόνιο».
Ιδιότητες δευτερίου
Το δευτέριο εμφανίζει αρκετές ενδιαφέρουσες ιδιότητες:
- Τόσο το δευτέριο όσο και το τρίτιο σχηματίζουν ισχυρότερους χημικούς δεσμούς από το συνηθισμένο υδρογόνο (πρώτιο).
- Το δευτέριο έχει σημαντικά υψηλότερο τριπλό σημείο, σημείο βρασμού, πίεση ατμών, θερμότητα σύντηξης και θερμότητα εξάτμισης από το συνηθισμένο υδρογόνο.
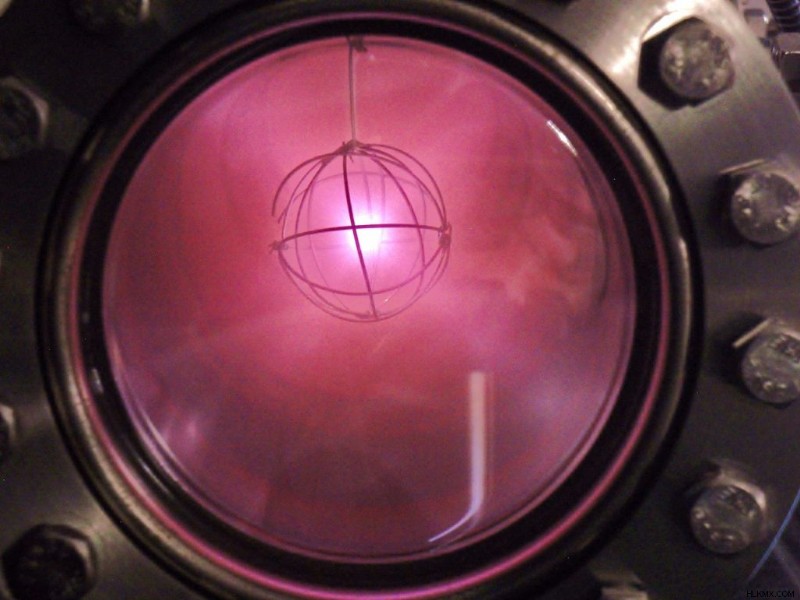
- Το αέριο δευτερίου είναι άχρωμο. Ωστόσο, εκπέμπει μια χαρακτηριστική ροζ λάμψη όταν ιονίζεται.
- Οι ισχυρότεροι δεσμοί σημαίνουν ότι το βαρύ νερό είναι περίπου 10,6 φορές πιο πυκνό από το κανονικό νερό (1,624 g/cm). Ο βαρύς πάγος νερού βυθίζεται σε κανονικό νερό, αν και επιπλέει σε βαρύ νερό.
- Το βαρύ νερό είναι επίσης πιο παχύρρευστο από το συνηθισμένο νερό. (12,6 μPa·s στ 300 Κ).
Περισσότερα στοιχεία για το Δευτέριο
- Το δευτέριο υποδεικνύεται με τα σύμβολα D ή H. Μερικές φορές ονομάζεται βαρύ υδρογόνο.
- Το δευτέριο είναι πολύ λιγότερο άφθονο από το πρωτίου. Αντιπροσωπεύει μόλις το 0,0156% του φυσικού υδρογόνου.
- Ο πυρήνας του δευτερίου ονομάζεται δευτερόνιο ή δευτερόνιο.
- Το δευτέριο είναι ένα από τα πέντε μόνο σταθερά ισότοπα που έχει και περιττό αριθμό πρωτονίων και περιττό αριθμό νετρονίων. Συνήθως, τα διπλά άτομα είναι ασταθή και υφίστανται διάσπαση βήτα.
- Το Δευτέριο υπάρχει σε άλλους πλανήτες εντός του ηλιακού συστήματος και μέσα σε άλλα αστέρια. Οι αέριοι γίγαντες του ηλιακού συστήματος περιέχουν περίπου την ίδια συγκέντρωση δευτερίου μεταξύ τους.
- Η φυσική αφθονία του δευτερίου ποικίλλει ανάλογα με την πηγή του.
- Το δευτέριο (όπως το πρωτίιο) γίνεται υγρό μέταλλο υπό ακραία πίεση.
- Το αντίστοιχο της αντιύλης ενός δευτερονίου είναι το αντιδετερόνιο, το οποίο αποτελείται από ένα αντιπρωτόνιο και ένα αντινετρόνιο. Το δευτέριο της αντιύλης ονομάζεται αντιδευτέριο και αποτελείται από ένα αντιδευτέριο και ποζιτρόνια.
Επιπτώσεις στην υγεία
Οι άνθρωποι δεν εκτίθενται σε βαρύ υδρογόνο (D2 ), αλλά οι επιστήμονες γνωρίζουν πολλά για τις επιπτώσεις του βαρέος νερού (D2 O) στο βιολογικό σύστημα.
Το συνηθισμένο νερό περιέχει πάντα ίχνη δευτερίου, επομένως η πρόσληψη λίγης ποσότητας από τα ισότοπα είναι φυσιολογική. Στην πραγματικότητα, μπορείτε να πιείτε λίγο βαρύ νερό δεν θα έχει αρνητικές επιπτώσεις. Χρησιμοποιείται ακόμη και σε ορισμένες ιατρικές διαγνωστικές εξετάσεις. Τα φύκια και τα βακτήρια μπορούν να ζουν σε καθαρό βαρύ νερό, αν και αναπτύσσονται πιο αργά. Οι άνθρωποι και άλλα ζώα παρουσιάζουν τοξικότητα από βαρύ νερό όταν το βαρύ νερό αντιπροσωπεύει περίπου το 20% του σωματικού βάρους. Τελικά, το βαρύ νερό διαταράσσει τη μίτωση αρκετά ώστε να προκαλέσει θάνατο. Είναι ενδιαφέρον να σημειωθεί ότι η τοξικότητα του βαρέος νερού επηρεάζει τα καρκινικά κύτταρα πιο δυσμενώς από ότι τα υγιή κύτταρα.
Ωστόσο, τα δευτεριωμένα φάρμακα προσφέρουν πολλά πιθανά οφέλη. Το δευτέριο βοηθά στην προστασία ορισμένων θρεπτικών συστατικών από την οξειδωτική βλάβη. Σταθεροποιεί τα ζωντανά εμβόλια, όπως το από του στόματος εμβόλιο κατά του ιού της πολιομυελίτιδας. Τα δευτεριωμένα φάρμακα μειώνουν τη γονοτοξικότητα των αντικαρκινικών φαρμάκων. Επειδή το δευτέριο συνδέεται με τον άνθρακα πιο ισχυρά από το κανονικό υδρογόνο, τα δευτεριωμένα φάρμακα μπορεί να διαρκέσουν περισσότερο πριν μεταβολιστούν. Το δευτέριο επιμηκύνει το ρολόι του κιρκάδιου ρυθμού. Το βαρύ νερό έχει αποδειχθεί ότι προστατεύει τα ποντίκια από την ακτινοβολία γάμμα.
Χρήσεις δευτερίου
Το δευτέριο έχει πολλές χρήσεις:
- Το δευτέριο βρίσκει χρήση σε αντιδραστήρες μέτριας σχάσης βαρέων υδάτων, συνήθως έχει βαρύ νερό, για να επιβραδύνει τα νετρόνια χωρίς να απορροφά πάρα πολλά από αυτά.
- Τα περισσότερα σχέδια αντιδραστήρων σύντηξης περιλαμβάνουν δευτέριο, συχνά με τρίτιο.
- Η απεικόνιση πυρηνικού μαγνητικού συντονισμού (NMR) χρησιμοποιεί δευτέριο ως διαλύτη, επειδή οι ιδιότητες του πυρηνικού σπιν διευκολύνουν το φιλτράρισμα του σήματος του.
- Οι τεχνικές σκέδασης νετρονίων χρησιμοποιούν δευτέριο για τη μείωση του θορύβου σκέδασης στα πειράματα.
- Το δευτέριο είναι ένας σταθερός ισότοπος ιχνηθέτης που είναι ανιχνεύσιμος με τη χρήση υπέρυθρης φασματομετρίας ή φασματομετρίας μάζας.
- Τα δευτεριωμένα φάρμακα δρουν διαφορετικά από τα φάρμακα που παρασκευάζονται με κανονικό υδρογόνο, προσφέροντας μια σειρά από ιατρικές δυνατότητες.
Πηγές Δευτερίου
Το μεγαλύτερο μέρος του δευτερίου που βρέθηκε σήμερα σχηματίστηκε κατά τη διάρκεια της Μεγάλης Έκρηξης. Αν και είναι δυνατό να κατασκευαστεί δευτέριο χρησιμοποιώντας πυρηνικό αντιδραστήρα, δεν είναι οικονομικά αποδοτικό. Έτσι, το μεγαλύτερο μέρος του δευτερίου προέρχεται από το διαχωρισμό του φυσικού βαρέος νερού από το κανονικό νερό.
Αναφορές
- IUPAC Commission on Nomenclature of Inorganic Chemistry (2001). «Ονομασίες για τα άτομα μιονίου και υδρογόνου και τα ιόντα τους». Καθαρή και Εφαρμοσμένη Χημεία . 73 (2):377–380. doi:10.1351/pac200173020377
- Kushner, D. J., Baker, A.; Dunstall, T. G. (1999). «Φαρμακολογικές χρήσεις και προοπτικές του βαρέος νερού και των δευτεριωμένων ενώσεων». Can J Physiol Pharmacol . 77(2)79-88.
- Lide, D. R., ed. (2005). Εγχειρίδιο CRC Χημείας και Φυσικής (86η έκδ.). Boca Raton (FL):CRC Press. ISBN 0-8493-0486-5.
- O'Leary, D. (Φεβρουάριος 2012). «Οι πράξεις στο δευτέριο». Χημεία της φύσης . 4 (3):236. doi:10.1038/nchem.1273
- Sanderson, K. (Μάρτιος 2009). «Μεγάλο ενδιαφέρον για τα βαριά ναρκωτικά». Φύση . 458 (7236):269. doi:10.1038/458269a