Αντίδραση αποσύνθεσης στη Χημεία
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μάθετε τι είναι η αντίδραση αποσύνθεσης και τα είδη της. Θα εξερευνήσετε επίσης μερικά από τα συναρπαστικά του παραδείγματα!
Θέματα που καλύπτονται σε άλλα άρθρα
- Τι είναι η χημική αντίδραση;
- Τύποι χημικών αντιδράσεων
- Χημικές εξισώσεις εξισορρόπησης
- Ενδόθερμες έναντι εξώθερμων αντιδράσεων
- Φυσικές και χημικές ιδιότητες
Τι είναι η αντίδραση αποσύνθεσης;
Οι αντιδράσεις αποσύνθεσης είναι χημικές αντιδράσεις στις οποίες μια αρχική ένωση διασπάται σε δύο ή περισσότερα απλούστερα συστατικά. Αυτά τα απλούστερα συστατικά μπορεί να είναι είτε στοιχεία είτε ενώσεις ή και τα δύο. Εδώ είναι ο γενικός τύπος μιας αντίδρασης αποσύνθεσης:
ΑΒ → A + B
(Το ΑΒ είναι το αντιδρόν. Α και Β είναι τα προϊόντα)
Οι αντιδράσεις αποσύνθεσης είναι γενικά ενδόθερμες γιατί το σπάσιμο των χημικών δεσμών απαιτεί εισροή ενέργειας. Ναι, ο σχηματισμός προϊόντων απελευθερώνει ενέργεια όταν σχηματίζουν νέους δεσμούς, αλλά αυτή η ενέργεια συνήθως δεν είναι αρκετή για να αντισταθμίσει την αρχική ενέργεια που χρησιμοποιείται για τη διάσπαση των δεσμών του αντιδρώντος.
Ωστόσο, σε σπάνιες περιπτώσεις όπου η ενέργεια σχηματισμού δεσμού των προϊόντων είναι μεγαλύτερη από την ενέργεια θραύσης δεσμού του αντιδραστηρίου (πιθανόν επειδή το αντιδραστήριο είναι εξαιρετικά αντιδραστικό), η αντίδραση αποσύνθεσης μπορεί να είναι εξώθερμη. Η αποσύνθεση του υπεροξειδίου του υδρογόνου, την οποία θα εξερευνήσουμε αργότερα, είναι μια τέτοια περίπτωση.
Τύποι αντιδράσεων αποσύνθεσης
Θυμάστε όταν είπα ότι για να ξεκινήσετε μια αντίδραση αποσύνθεσης, χρειάζεστε μια εισροή ενέργειας; Λοιπόν, αυτή η εισροή ενέργειας μπορεί να είναι θερμότητα, φως ή ηλεκτρισμός.
Θερμική αποσύνθεση (Θερμόλυση)
Η θερμόλυση συμβαίνει όταν η θερμότητα διασπά χημικά μια ένωση. Δηλαδή η θερμότητα είναι ένα αντιδραστήριο. παρέχουμε θερμότητα για να ξεκινήσει η αντίδραση.
Ας ρίξουμε μια ματιά σε ένα παράδειγμα:η αποσύνθεση του ανθρακικού ασβεστίου (CaCO3 ).
CaCO3 (s) + Δ → CaO (s) + CO2 (ζ) (Δ σημαίνει θερμότητα)
(Έβαλα το Δ ως αντιδραστήριο επειδή είναι πιο εύκολο να το κάνετε σε έναν υπολογιστή. Είναι πολύ καλό να βάλετε το Δ στο βέλος αντίδρασης. Το ίδιο ισχύει και για το hν παρακάτω.)
Εάν επρόκειτο να εκτελέσετε αυτήν την αντίδραση στην πραγματική ζωή, θα παρατηρούσατε ότι το αρχικό στερεό δείγμα CaCO3 θα γινόταν αρκετά εύθρυπτο αφού το ζεστάνετε και λίγο αέριο θα ανέβει κατά τη διάρκεια της διαδικασίας. Αυτά είναι σημάδια ότι έχουν συμβεί κάποιες χημικές αλλαγές. Πράγματι, το CaCO σας3 έχει αποσυντεθεί σε εύθρυπτο CaO και CO2 αέριο.
Φωτοσύνθεση (Φωτόλυση)
Η φωτόλυση συμβαίνει όταν το φως (ή πιο συγκεκριμένα, τα φωτόνια) διασπά χημικά μια ένωση. Ένα παράδειγμα φωτόλυσης μπορεί να βρεθεί ανάμεσα στις εξαρτώμενες από το φως αντιδράσεις της διαδικασίας φωτοσύνθεσης ενός φυτού:
H2 O + hν → 2 H + 2 e + 1/2 O2 (hν σημαίνει φως)
Εδώ, το νερό απορροφά το φως (συγκεκριμένα, 2 φωτόνια) και αποσυντίθεται σε πρωτόνια (Η), ηλεκτρόνια (e) και μοριακό οξυγόνο.
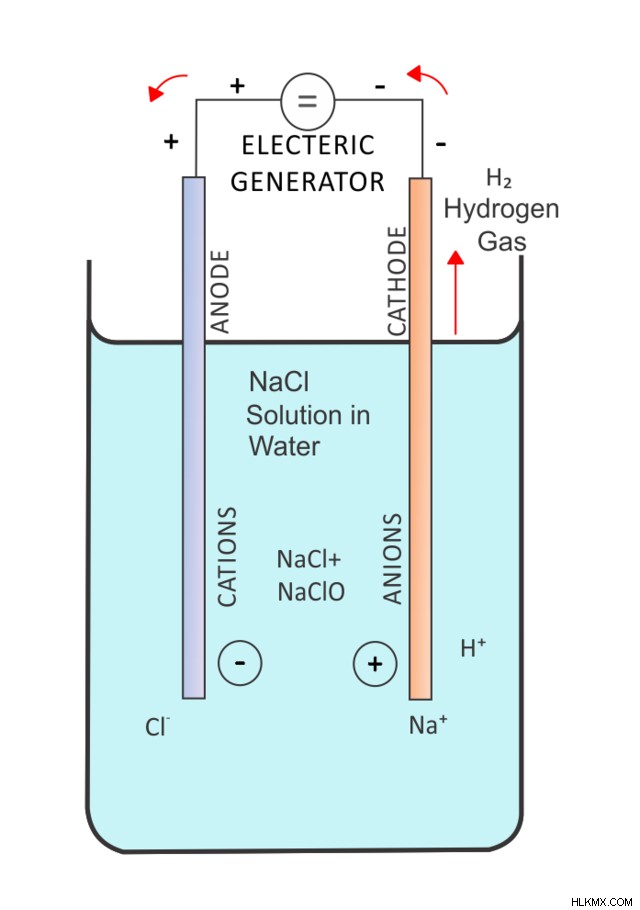
Ηλεκτρόλυση
Έχουμε ένα ολόκληρο άρθρο αφιερωμένο στην ηλεκτρόλυση:Ηλεκτρολυτικά κύτταρα και ηλεκτρόλυση! Ρίξτε μια ματιά αν θέλετε να μάθετε περισσότερα για αυτήν την ηλεκτρισμένη τεχνική (λογοπαίγνιο που προορίζεται σίγουρα)!
Εν πάση περιπτώσει, η ηλεκτρόλυση συμβαίνει όταν ο ηλεκτρισμός διασπά χημικά μια ένωση. Μια αντίδραση ηλεκτρόλυσης είναι ο συνδυασμός 2 ταυτόχρονων ημι-αντιδράσεων (μια αντίδραση αναγωγής και μια αντίδραση οξείδωσης).
Ας ρίξουμε μια ματιά σε ένα παράδειγμα:την ηλεκτρόλυση του χλωριούχου νατρίου (NaCl).
2 NaCl (l) → 2 Na (l) + Cl2 (ζ)
Σε αυτή την αντίδραση, το NaCl αποσυντίθεται σε υγρό μέταλλο νατρίου και αέριο χλώριο. Οι 2 ημι-αντιδράσεις που εμπλέκονται είναι η αναγωγή των ιόντων Na και η οξείδωση των ιόντων Cl.
Παραδείγματα αντιδράσεων αποσύνθεσης
Όπως υποσχεθήκαμε νωρίτερα, ας εξερευνήσουμε την αποσύνθεση του υπεροξειδίου του υδρογόνου (H2 O2 ).
2 H2 O2 (aq) → 2 H2 O (l) + O2 (ζ)
Δεδομένου ότι ο δεσμός οξυγόνου-οξυγόνου στο υπεροξείδιο του υδρογόνου είναι εξαιρετικά ασταθής, το υπεροξείδιο του υδρογόνου που αποθηκεύεται σε φιάλες αποσυντίθεται σε νερό και αέριο οξυγόνο όλη την ώρα. Ωστόσο, αν θέλετε κάτι πιο διασκεδαστικό (και επικίνδυνο), μπορείτε να δοκιμάσετε να επιταχύνετε την αποσύνθεσή του χρησιμοποιώντας έναν καταλύτη όπως το υπερμαγγανικό κάλιο (KMnO4 ), όπως φαίνεται στο παρακάτω βίντεο. Μια τέτοια αντίδραση είναι εξαιρετικά εξώθερμη—μπορεί να φτάσει σε πολύ υψηλές θερμοκρασίες και να απελευθερώσει πολύ αέριο (το μεγαλύτερο μέρος των οποίων είναι υδρατμοί). Επομένως, μην πραγματοποιείτε την αντίδραση στο σπίτι, εκτός εάν έχετε τα προσόντα να το κάνετε.
Παρεμπιπτόντως, η αποσύνθεση του υπεροξειδίου του υδρογόνου παίζει επίσης σημαντικό ρόλο στην παρασκευή της οδοντόκρεμας Elephant!
Άλλες δημοφιλείς αντιδράσεις αποσύνθεσης είναι η αποσύνθεση υδροξειδίων μετάλλων . Τα υδροξείδια μετάλλων αποσυντίθενται σε οξείδια μετάλλων και νερό κατά τη θέρμανση. Ακολουθούν μερικά παραδείγματα:
- Αποσύνθεση υδροξειδίου του νατρίου :2 NaOH (s) + Δ → Na2 O (s) + H2 O (g)
- Υδροξείδιο του ασβεστίου :Ca(OH)2 + Δ → CaO + H2 O
- Υδροξείδιο του σιδήρου (III) :2 Fe(OH)3 + Δ → Fe2 O3 + 3 H2 O
Περαιτέρω αναγνώσεις
- Αντιδράσεις καύσης
- Γράφημα χημικών αντιδράσεων
- Τι είναι η Ηλεκτροχημεία;
- Το στοιχείο ασβέστιο με κιμωλία




