Ατομικό μοντέλο Rutherford
Ορισμός του μοντέλου Rutherford
Το ατομικό μοντέλο Rutherford έχει 2 κύρια μέρη:τον πυρήνα και τον υπόλοιπο χώρο του ατόμου, που καταλαμβάνεται από ηλεκτρόνια.
Σύμφωνα με το μοντέλο, ο πυρήνας είναι ένα πολύ μικρό μέρος του όγκου του ατόμου. Καταλαμβάνει ένα μικρό χώρο στο κέντρο του ατόμου. Τα πρωτόνια και τα νετρόνια αποτελούν τον πυρήνα και καθορίζουν τις χημικές ιδιότητες του ατόμου.
Ο Rutherford ισχυρίστηκε επίσης στο μοντέλο του ότι τα ηλεκτρόνια περιστρέφονται γύρω από τον πυρήνα σε καθορισμένες τροχιές, όπως οι πλανήτες που περιστρέφονται γύρω από τον Ήλιο. Αυτό το μέρος της θεωρίας ήταν ανακριβές, όπως εξηγήθηκε στην τελευταία ενότητα.

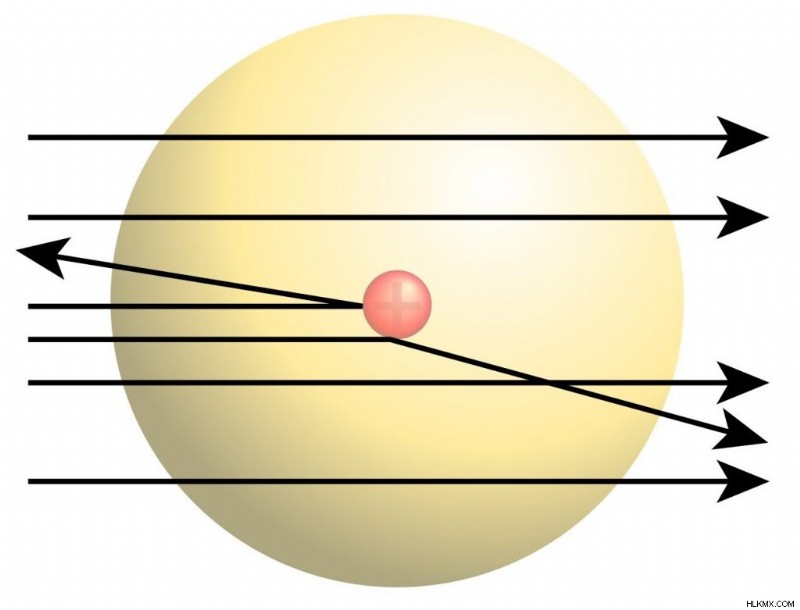
Πείραμα του Rutherford's Gold Foil
Το πείραμα με φύλλο χρυσού Rutherford, γνωστό και ως πείραμα σκέδασης, οδήγησε στη δημιουργία του μοντέλου και εξήγησε τα μέρη του ατόμου. Το 1909, ο μεταπτυχιακός φοιτητής Ernest Marsden (υπό την επίβλεψη του Ernest Rutherford) εκτόξευσε σωματίδια άλφα σε ένα κομμάτι φύλλου χρυσού. Τα περισσότερα από τα σωματίδια περνούσαν απευθείας μέσα από το φύλλο, που σημαίνει ότι το μεγαλύτερο μέρος του χώρου σε κάθε άτομο ήταν ακατειλημμένο. Ωστόσο, μερικά σωματίδια εκτρέπονται, και μερικά ακόμη και προς τα πίσω. Αυτό πρέπει να προκλήθηκε από μικροσκοπικούς θύλακες θετικού φορτίου στο φύλλο που απωθούν τα σωματίδια άλφα πίσω. Η ανακάλυψή τους οδήγησε στη δημιουργία του μοντέλου του Ράδερφορντ, στο οποίο ο πυκνός, θετικά φορτισμένος πυρήνας καταλαμβάνει μια πολύ μικρή περιοχή στο κέντρο κάθε ατόμου.
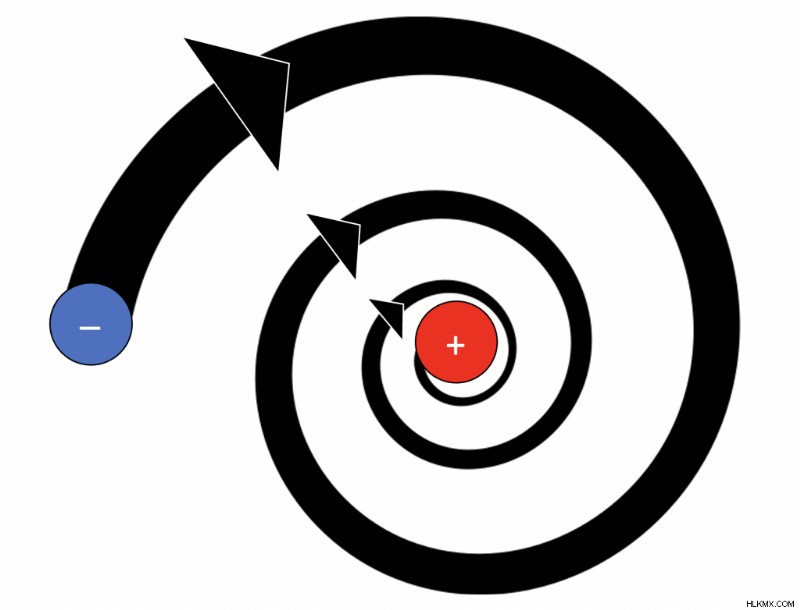
Αδυναμίες του μοντέλου Rutherford
Ενώ τα κοινά μοντέλα σήμερα βασίζονται στην ατομική θεωρία του Ράδερφορντ, δεν απεικονίζει την πλήρη εικόνα:
- Λείπουν τμήματα από το μοντέλο και δεν λαμβάνει υπόψη τη θέση ή την κατανομή των ηλεκτρονίων.
- Ο Rutherford πρότεινε ότι τα ηλεκτρόνια περιφέρονται γύρω από τον πυρήνα σε καθορισμένες διαδρομές, αλλά σύμφωνα με τη θεωρία του Maxwell, αυτό δεν είναι δυνατό επειδή το άτομο δεν θα ήταν σταθερό. Η ηλεκτρομαγνητική ακτινοβολία από τα ηλεκτρόνια σε τροχιά θα προκαλούσε την κατάρρευση του ατόμου στον πυρήνα σε 10 δευτερόλεπτα.
- Τα ηλεκτρόνια αυξάνουν και μειώνουν τα επίπεδα ενέργειας τυχαία λόγω της επιτάχυνσης και δεν βρίσκονται πάντα σε μια τυπική κυκλική τροχιά. Εκπέμπουν ηλεκτρομαγνητική ακτινοβολία λόγω της κυκλικής κίνησης της τροχιάς. έτσι πρέπει να έχουν κάποια αρχική ενέργεια από το νόμο της διατήρησης της ενέργειας. Το ατομικό μοντέλο Rutherford δεν λαμβάνει υπόψη την αρχική ενέργεια και τις επακόλουθες αλλαγές στο ενεργειακό επίπεδο.
Περαιτέρω ανάγνωση
- Ατομική Θεωρία του Ντάλτον
- Ατομικό μοντέλο Bohr
- Η δομή ενός ατόμου