Ηλεκτρόφιλο- Τι είναι;
Βασικές έννοιες
Σε αυτό το σεμινάριο, θα μάθετε πώς να προσδιορίζετε εάν ένα μόριο μπορεί να λειτουργήσει ως ηλεκτρόφιλο. Αυτό θα γίνει με την κατανόηση των εννοιών σχετικά με τη δομή ενός ηλεκτροφίλου που μπορούν να επηρεάσουν την ικανότητά του να αντιδρά. Επιπλέον, θα μάθετε μια λίστα ηλεκτρόφιλων.
Θέματα που καλύπτονται σε άλλα άρθρα
- Πυρηνόφιλα
- Ηλεκτρόφιλη αρωματική υποκατάσταση
- Κατιόντα και ανιόντα
- Ιωνικοί και ομοιοπολικοί δεσμοί
- Δομές συντονισμού
Λεξιλόγιο
- Κατιόν- ένα θετικά φορτισμένο ιόν
- Ομοιοπολικός δεσμός- η κατανομή ηλεκτρονίων μεταξύ δύο μη μετάλλων ή μετάλλων και μεταλλοειδών
- Ηλεκτρόνιο- το αρνητικά φορτισμένο υποατομικό σωματίδιο που βρίσκεται έξω από τον πυρήνα
- Βύθιση ηλεκτρονίων- μια θέση φτωχή σε ηλεκτρόνια σε ένα μόριο
- Ηλεκτροφιλικότητα- η ικανότητα μιας ένωσης να δρα ως ηλεκτρόφιλη
- Φεύγουσα ομάδα- ένα άτομο ή ομάδα που μπορεί να αποσπαστεί από ένα μόριο
- Δομή συντονισμού- οι διαφορετικοί τρόποι με τους οποίους τα ηλεκτρόνια μπορούν να κινηθούν σε ένα μόριο, δημιουργώντας διαφορετικά φορτία και θέσεις για πιθανές αντιδράσεις
- Στειρικό εμπόδιο- η επίδραση που έχει το φυσικό μέγεθος και η δομή ενός μορίου στην αντιδραστικότητά του
Εισαγωγή στα Ηλεκτρόφιλα
Ένα ηλεκτρόφιλο είναι ένα μόριο φτωχό σε ηλεκτρόνια που μπορεί να σχηματίσει ομοιοπολικούς δεσμούς δεχόμενος ηλεκτρόνια από ένα πυρηνόφιλο, ένα μόριο πλούσιο σε ηλεκτρόνια. Στις οργανικές αντιδράσεις, πολλά μόρια μπορούν να λειτουργήσουν ως ηλεκτρόφιλα, αλλά υπάρχουν ορισμένοι τρόποι με τους οποίους ένα μόριο μπορεί να γίνει ένα. Μάθετε περισσότερα για τα ηλεκτρόφιλα παρακάτω!
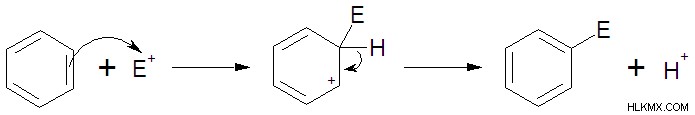
Ποιοι παράγοντες συνθέτουν ένα καλό ηλεκτρόφιλο;
Χρέωση
Η δυνατότητα ενός μορίου να λειτουργεί ως ηλεκτρόφιλο εξαρτάται από την ικανότητά του να είναι καταβόθρα ηλεκτρονίων και να δέχεται αρνητικό φορτίο. Δεδομένου ότι το μόριο πρέπει να έχει έλλειψη ηλεκτρονίων για να δεχτεί τον δεσμό με μια πηγή ηλεκτρονίων, ένα θετικό μόριο θα είναι το καλύτερο ηλεκτρονιακό.
Ένα ουδέτερο μόριο μπορεί επίσης να είναι ένα καλό ηλεκτρόφιλο λόγω συντονισμού. Εάν είναι δυνατή μια δομή συντονισμού, τότε πιθανότατα υπάρχει μια βύθιση ηλεκτρονίων σε μια θέση δεσμού, η οποία μπορεί να δεχθεί ηλεκτρόνια για να σχηματίσει έναν δεσμό. Επιπλέον, σε ένα ουδέτερο μόριο, εάν υπάρχει μια καλή αποχωρούσα ομάδα, η απομάκρυνσή της μπορεί να προκαλέσει άδειασμα ενός τροχιακού και να δημιουργήσει θετικό φορτίο.
Από την άλλη πλευρά, δεδομένου ότι ένα ανιόν είναι πηγή ηλεκτρονίων, δεν μπορεί να δεχτεί περισσότερα ηλεκτρόνια και επομένως δεν μπορεί να είναι επαρκές ηλεκτρόφιλο.
Τύπος ομολόγου
Τα καλά ηλεκτρόφιλα τυπικά περιέχουν ασθενείς πολικούς ή πολωτικούς δεσμούς. Αυτό σημαίνει ότι τα ηλεκτρόνια μπορούν να ευνοήσουν τη μία πλευρά ενός δεσμού έναντι της άλλης, δημιουργώντας δίπολα. Αυτοί οι δεσμοί θα περιέχουν ένα μερικό θετικό φορτίο στη μία πλευρά, συνήθως έναν άνθρακα σε ένα μόριο υδρογονάνθρακα, και ένα μερικό αρνητικό φορτίο από την άλλη, συνήθως μια πιο ηλεκτραρνητική ένωση όπως το οξυγόνο. η μερική θετική πλευρά του δεσμού θα είναι πιο ηλεκτρόφιλη.
Στειρικό εμπόδιο
Όσο πιο συνωστισμός είναι μια θέση δυνητικού δεσμού, τόσο λιγότερο πιθανό είναι το άλλο μόριο να μπορεί να μοιραστεί τα ηλεκτρόνια του για να σχηματίσει τον ομοιοπολικό δεσμό. Αυτό, γνωστό ως στερικό εμπόδιο, αυξάνεται καθώς αυξάνεται ο αριθμός των δεσμών σε μόρια άλλα από το υδρογόνο που γειτνιάζουν με την ηλεκτροφιλική θέση. Αυτό μπορεί να περιορίσει τον τύπο της αντίδρασης που μπορεί να πραγματοποιηθεί. Επομένως, όσο λιγότερο στερεοχημικά παρεμποδίζεται ένα μόριο, τόσο πιο εύκολο θα είναι για αυτό να υποστεί διαφορετικές αντιδράσεις.
Για να μάθετε περισσότερα σχετικά με τους περιορισμούς αντίδρασης, διαβάστε εδώ!
Λίστα Ηλεκτρόφιλων
- Ιόν υδρογόνου- H
- Ιόν υδρονίου- H3 O
- Χλωριούχα οξέα- CH3 COCl
- Διοξείδιο του άνθρακα – CO2
- Διατομικά αλογόνα- Br2 , I2 , F2
- Αλκυλ αλογονίδια- CH3 CH2 Br
Περαιτέρω ανάγνωση
- Δυνάμεις Διπόλων Ιόντων
- Πολικοί δεσμοί έναντι μη πολικών δεσμών
- Δομή ενός ατόμου




