Διαφορά μεταξύ S τροχιακού και P τροχιακού
Κύρια διαφορά – S τροχιακό vs τροχιακό P
Ένα άτομο αποτελείται από ηλεκτρόνια τα οποία βρίσκονται σε συνεχή κίνηση προς οποιαδήποτε κατεύθυνση γύρω από τον πυρήνα. Δεδομένου ότι κινούνται γύρω από τον πυρήνα, δεν μπορούμε να προσδιορίσουμε την ακριβή θέση αυτού του ηλεκτρονίου σε μια δεδομένη στιγμή. Μπορούμε μόνο να μαντέψουμε την πιθανότητα ενός ηλεκτρονίου να βρίσκεται σε μια θέση. Αυτό το φαινόμενο ονομάζεται Αρχή αβεβαιότητας Heisenberg . Σύμφωνα με αυτές τις πιθανότητες, οι περιοχές όπου μπορεί να βρεθεί ένα ηλεκτρόνιο με την υψηλότερη πιθανότητα εξηγούνται με τον όρο τροχιακό. Μπορεί να υπάρχουν διαφορετικά τροχιακά ανάλογα με τις ενέργειες και τις κινήσεις των ηλεκτρονίων γύρω από τον πυρήνα. Το S τροχιακό και το p τροχιακό είναι δύο τέτοια τροχιακά. Η κύρια διαφορά μεταξύ του s τροχιακού και του p τροχιακού είναι ότι τα s τροχιακά έχουν σφαιρικό σχήμα ενώ τα τροχιακά p έχουν σχήμα αλτήρα.
Βασικές περιοχές που καλύπτονται
1. Τι είναι το S Orbital
– Ορισμός, σχήμα και δομικές ιδιότητες
2. Τι είναι το P Orbital
– Ορισμός, σχήμα και δομικές ιδιότητες
3. Ποιες είναι οι ομοιότητες μεταξύ S Orbital και P Orbital
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ S Orbital και P Orbital
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Άτομο, Αρχή Αβεβαιότητας Heisenberg, Τροχιακά, Ρ Τροχιακό, Πιθανότητα, Τροχιακό S 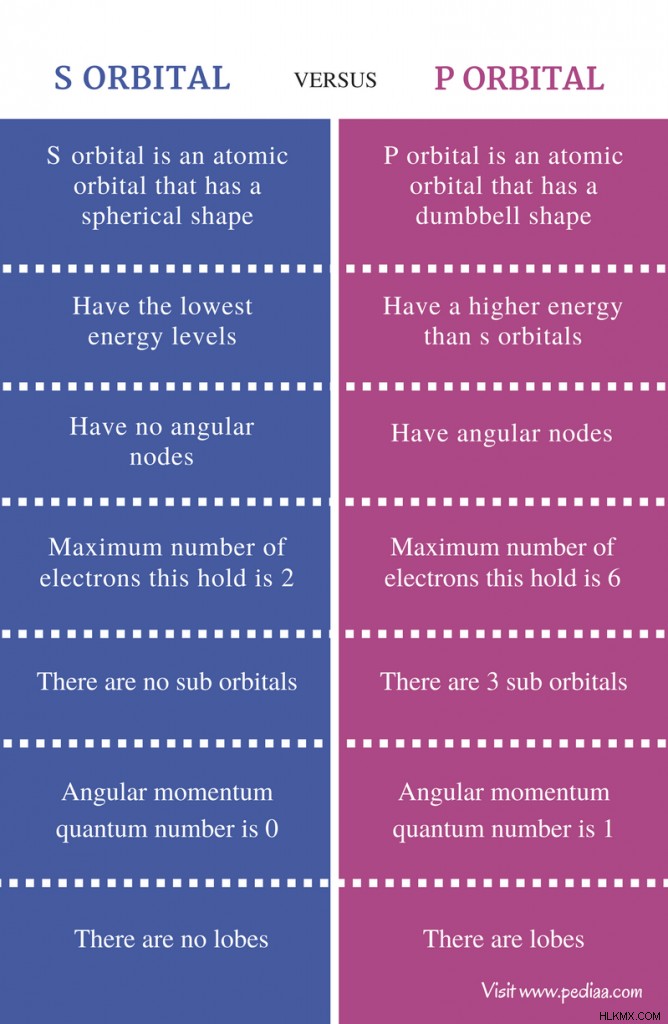
Τι είναι το S Orbital
Το τροχιακό S είναι ένα ατομικό τροχιακό που έχει σφαιρικό σχήμα. Έχει τη χαμηλότερη ενέργεια σε σύγκριση με άλλα ατομικά τροχιακά. Κάθε φλοιό ηλεκτρονίων έχει τουλάχιστον ένα s τροχιακό. Το S τροχιακό είναι το απλούστερο ατομικό τροχιακό μεταξύ άλλων τροχιακών. Ένα τροχιακό μπορεί να χωρέσει το πολύ δύο ηλεκτρόνια. Τα τροχιακά S δεν έχουν υποτροχιακά. Το γράμμα "s" σημαίνει "κοφτερό". Αυτό το τροχιακό ονομάστηκε έτσι λαμβάνοντας υπόψη τη γωνιακή ορμή των ηλεκτρονίων σε αυτό το τροχιακό. Δεδομένου ότι τα ατομικά τροχιακά αποτελούνται από ένα καθορισμένο ενεργειακό επίπεδο (η ενέργεια κβαντίζεται), τους δίνεται ένας κβαντικός αριθμός. Το S τροχιακό εκχωρεί τον κβαντικό αριθμό της γωνιακής ορμής ενός ατόμου.
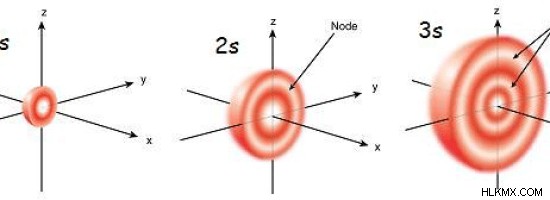
Εικόνα 1:Το μέγεθος του τροχιακού s αυξάνεται με την αύξηση του κύριου κβαντικού αριθμού
Τα δύο ηλεκτρόνια στο τροχιακό s έχουν αντίθετα σπιν. Τα τροχιακά S εμπλέκονται σε χημικούς δεσμούς. Μπορούν να συμμετέχουν στο σχηματισμό δεσμών σίγμα. Αλλά αυτά τα τροχιακά s δεν μπορούν να σχηματίσουν δεσμούς pi. Το σφαιρικό σχήμα μας λέει την πιο πιθανή περιοχή όπου μπορούν να βρεθούν τα ηλεκτρόνια. Τα τροχιακά S δεν έχουν γωνιακούς κόμβους. Επομένως, ο κβαντικός αριθμός της γωνιακής ορμής του τροχιακού s είναι 0.
Το τροχιακό S έχει τη χαμηλότερη ενέργεια από όλα τα άλλα τροχιακά στο ίδιο κέλυφος ηλεκτρονίων. Σε υψηλότερα κελύφη ηλεκτρονίων (κύριος κβαντικός αριθμός =n), το τροχιακό s έχει μικρότερη ενέργεια από εκείνη των d τροχιακών στο πλησιέστερο χαμηλότερο κέλυφος (n-1). Το μέγεθος της τροχιακής σφαίρας s αυξάνεται με την αύξηση του αρχικού κβαντικού αριθμού.
Τι είναι το P Orbital
Το τροχιακό P είναι ένα ατομικό τροχιακό που έχει σχήμα αλτήρα. Τα τροχιακά P έχουν μεγαλύτερη ενέργεια από αυτή των τροχιακών s. Το γράμμα "p" σημαίνει "κύριο". Περιγράφει τη γωνιακή ορμή των ηλεκτρονίων στο τροχιακό p. Ένα p τροχιακό μπορεί να χωρέσει το πολύ 6 ηλεκτρόνια. Αυτά τα ηλεκτρόνια καταλαμβάνουν υποατομικά τροχιακά. Ένα υποατομικό τροχιακό μπορεί να χωρέσει το πολύ δύο ηλεκτρόνια. Επομένως, ένα τροχιακό p έχει τρία υποατομικά τροχιακά. Ονομάζονται ως px, py και pz. Γενικά, όλα αυτά ονομάζονται τροχιακά p.
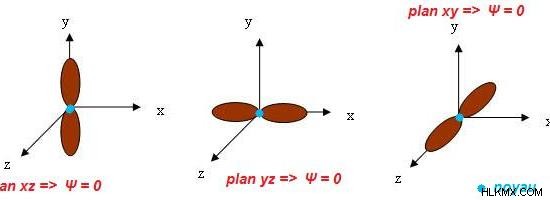
Εικόνα 2:Σχήματα και προσανατολισμοί τριών τροχιακών P
Τα τρία υποτροχιακά του p τροχιακού διαφέρουν μεταξύ τους ανάλογα με τον προσανατολισμό αυτών των τροχιακών σε ένα άτομο. Ωστόσο, μοιάζουν στο σχήμα τους. Όλα αυτά τα υποτροχιακά έχουν σχήμα αλτήρα. Ένα ιδιαίτερο χαρακτηριστικό για το p τροχιακό είναι ότι αποτελείται από έναν γωνιακό κόμβο. Επομένως, ο κβαντικός αριθμός γωνιακής ορμής του p τροχιακού είναι 1.
Εκτός από το φλοιό ηλεκτρονίων που έχει τον κύριο κβαντικό αριθμό 1, όλα τα άλλα κελύφη ηλεκτρονίων αποτελούνται από τροχιακά p. Το μέγεθος των τροχιακών p αυξάνεται με την αύξηση του κύριου κβαντικού αριθμού. Ένα τροχιακό p έχει δύο λοβούς. Αυτοί οι λοβοί είναι συμμετρικοί κατά μήκος του άξονά τους. Αυτά τα τροχιακά p εμπλέκονται σε χημικούς δεσμούς. Μπορούν να σχηματίσουν είτε δεσμούς σίγμα είτε δεσμούς π. Τα υποτροχιακά P στον οριζόντιο προσανατολισμό μπορούν για δεσμούς σίγμα. Άλλα δύο υποτροχιακά εμπλέκονται στον δεσμό π.
Ομοιότητες μεταξύ S Orbital και P Orbital
- Το S τροχιακό και το P τροχιακό είναι τύποι ατομικών τροχιακών.
- Και οι δύο όροι περιγράφουν τη γωνιακή ορμή των ηλεκτρονίων σε αυτό το τροχιακό.
- Και τα δύο τροχιακά εμπλέκονται στον δεσμό σίγμα.
Διαφορά μεταξύ S Orbital και P Orbital
Ορισμός
S τροχιακό: Το S τροχιακό είναι ένα ατομικό τροχιακό που έχει σφαιρικό σχήμα.
Π τροχιακό: Το P τροχιακό είναι ένα ατομικό τροχιακό που έχει σχήμα αλτήρα.
Επίπεδο ενέργειας
S τροχιακό: Τα τροχιακά S έχουν τα χαμηλότερα επίπεδα ενέργειας.
Π τροχιακό: Τα τροχιακά P έχουν μεγαλύτερη ενέργεια από τα τροχιακά s.
Γωνιακοί κόμβοι
S τροχιακό: Τα τροχιακά δεν έχουν γωνιακούς κόμβους.
Π τροχιακό: Τα τροχιακά p έχουν γωνιακούς κόμβους
Μέγιστος αριθμός ηλεκτρονίων
S τροχιακό: Ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να χωρέσει ένα τροχιακό είναι 2.
Π τροχιακό: Ο μέγιστος αριθμός ηλεκτρονίων που μπορεί να χωρέσει ένα τροχιακό p είναι 6.
Υποτροχιακά
S τροχιακό: Δεν υπάρχουν υποτροχιακά στα τροχιακά s.
Π τροχιακό: Υπάρχουν 3 υποτροχιακά στο p τροχιακό.
Κβαντικός αριθμός γωνιακής ορμής
S τροχιακό: Ο κβαντικός αριθμός της γωνιακής ορμής του τροχιακού s είναι 0.
Π τροχιακό: Ο κβαντικός αριθμός γωνιακής ορμής του p τροχιακού είναι 1.
Λοβοί
S τροχιακό: Δεν υπάρχουν λοβοί στα τροχιακά.
Π τροχιακό: Υπάρχουν λοβοί που υπάρχουν στα p τροχιακά.
Συμπέρασμα
Τόσο τα τροχιακά s όσο και τα τροχιακά p είναι ατομικά τροχιακά. Αυτά τα τροχιακά υποδεικνύουν την πιο πιθανή περιοχή όπου μπορούμε να βρούμε ένα ηλεκτρόνιο αυτού του ατόμου. Η κύρια διαφορά μεταξύ του s τροχιακού και του p τροχιακού είναι ότι τα τροχιακά s έχουν σφαιρικό σχήμα ενώ τα τροχιακά p έχουν σχήμα αλτήρα.




