Εστερική Λειτουργική Ομάδα και Εστεροποίηση
Βασικές έννοιες σε λειτουργικές ομάδες εστέρα
Σε αυτό το σεμινάριο θα μάθετε για τις βασικές ιδιότητες και τη δομή μιας λειτουργικής ομάδαςεστέρα. Θα μάθετε επίσης για την εστεροποίηση και ο μηχανισμός του.
Θέματα που καλύπτονται σε άλλα άρθρα
- Λειτουργικές ομάδες στην Οργανική Χημεία
- Πυρηνόφιλο – Τι είναι;
- Αντίδραση Sn1
- Αντίδραση Sn2
Τι είναι μια λειτουργική ομάδα εστέρα;
Στην οργανική χημεία, οι εστέρες αποτελούν κοινή λειτουργική ομάδα. Η βασική δομή ενός εστέρα αποτελείται από έναν άνθρακα που συνδέεται με τον άνθρακα, τον διπλό δεσμό με το οξυγόνο και τον απλό δεσμό με το οξυγόνο. Για το παρακάτω μόριο, εμφανίζεται η απλή δομή μιας εστερικής ομάδας.
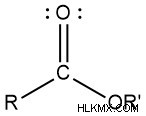
Ο βασικός χημικός τύπος ενός εστέρα είναι R-COOR'. Οι ομάδες R υποδηλώνουν το υπόλοιπο του μορίου που δεν περιλαμβάνεται στη λειτουργική ομάδα.
Τι είναι ο Εστερικός δεσμός;
Ένας εστερικός δεσμός είναι μια σύνδεση μεταξύ ενός ατόμου που είναι διπλά συνδεδεμένο με ένα άτομο οξυγόνου που φέρει οποιαδήποτε αλκυλ ή αρυλ ομάδα. Οι εστερικοί δεσμοί βρίσκονται σε εστερικές λειτουργικές ομάδες. Επιπλέον, ο δεσμός είναι γενικά ομοιοπολικός και είναι απαραίτητος για το σχηματισμό λιπιδίων.
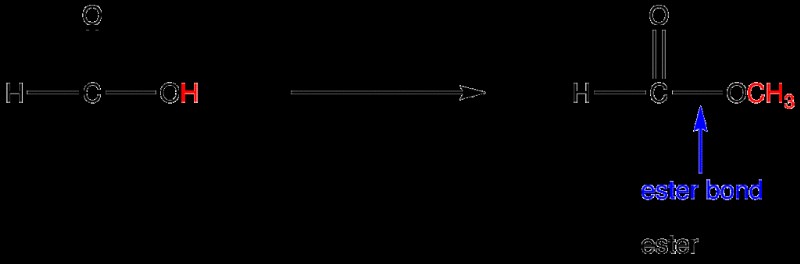
Αυτοί οι εστερικοί δεσμοί είναι σημαντικοί όταν πρόκειται για λιπίδια στο σώμα μας. Όταν η γλυκερίνη (οινόπνευμα) συνδυάζεται με μόρια λιπαρών οξέων, επιτρέπει την παραγωγή τριών εστέρων. Αυτή η διαδικασία είναι που προκαλεί το σχηματισμό εστερικών δεσμών.
Ιδιότητες των εστέρων
Σε σύγκριση με τις αλκοόλες και τα καρβοξυλικά οξέα, οι εστέρες τείνουν να είναι λιγότερο πολικοί επιτρέποντάς τους να έχουν χαμηλότερα σημεία βρασμού. Λόγω της πολικής ιδιότητας των εστέρων, μπορούν να συμμετέχουν στους δεσμούς υδρογόνου ως δέκτες δεσμών υδρογόνου. Η ικανότητά τους να συμμετέχουν σε δεσμούς υδρογόνου εξαρτάται από το μήκος των αλκυλικών αλυσίδων που συνδέονται με τη λειτουργική ομάδα του εστέρα.
Ονομασία εστέρων
Το όνομα ενός εστέρα προέρχεται από τη μητρική αλκοόλη και το μητρικό οξύ. Ενώ οι απλοί εστέρες μπορούν να ονομαστούν από τα κοινά τους ονόματα, όλοι οι εστέρες μπορούν να ονομαστούν χρησιμοποιώντας το συστηματικό τους όνομα IUPAC. Το όνομα βασίζεται στο οξύ που ακολουθείται από το επίθημα «-oate».
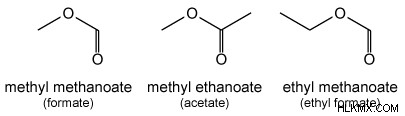
Όταν ένας εστέρας σχηματίζεται από ένα κοινό καρβοξυλικό οξύ, υπάρχουν υποκαταστάσεις για το όνομα IPUAC του εστέρα.
- "αιθανοϊκό" ="οξικό"
- "μεθανοϊκό" ="μυρμηκικό"
- “propanoate” =“propionate”
- "βουτανοϊκό" ="βουτυρικό"
Παραδείγματα λειτουργικών ομάδων εστέρα
Οι εστέρες είναι συνηθισμένοι στη φύση. Οι εστέρες έχουν γενικά ευχάριστες οσμές και ευθύνονται για τα χαρακτηριστικά αρώματα των φρούτων και των λουλουδιών. Οι αρωματικοί παράγοντες και τα αρώματα περιέχουν φυσικούς και συνθετικούς εστέρες.
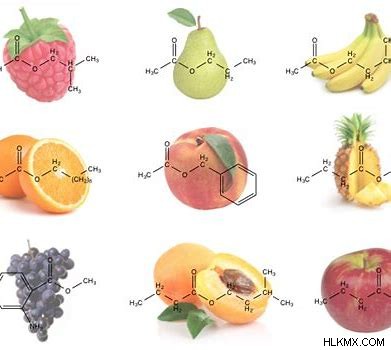
Τα λίπη και τα φυτικά έλαια είναι μακράς αλυσίδας λιπαρά οξέα και γλυκερόλη που έχουν εστέρες. Επιπλέον, οι εστέρες των φωσφορικών οξέων έχουν τη μέγιστη σημασία για τη ζωή. Μερικά κοινά παραδείγματα εστέρων και τα ονόματά τους βρίσκονται στην παρακάτω λίστα.
- μεθανοϊκός/μυρμηκικός μεθυλεστέρας (HCOOCH3 )
- αιθανοϊκός μεθυλεστέρας/οξικός (CH3 COOCH3 )
- αιθανοϊκός/οξικός αιθυλεστέρας (CH3 COOCH2 CH3 )
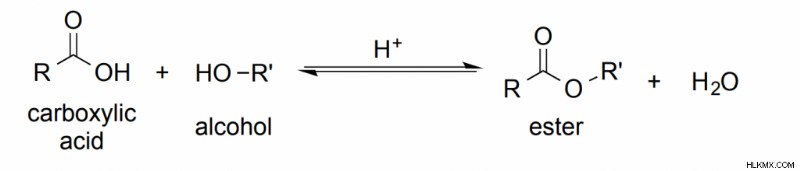
Εστεροποίηση
Τι είναι η εστεροποίηση;
Η εστεροποίηση Fischer είναι η πιο κοινή αντίδραση για την παραγωγή απλών εστέρων και περιλαμβάνει την ανάμειξη ενός καρβοξυλικού οξέος και μιας αλκοόλης με μια μικρή ποσότητα καταλυτικού οξέος. Η αντίδραση μπορεί να ολοκληρωθεί μέσω αναρροής (παρουσία πολλής ενέργειας). Η υπερβολική θερμότητα είναι απαραίτητη για την εστεροποίηση, καθώς χρειάζεται πολλή ενέργεια για να αφαιρεθεί η ομάδα «-OH» από ένα καρβοξυλικό οξύ για να δημιουργηθεί ένας εστέρας.
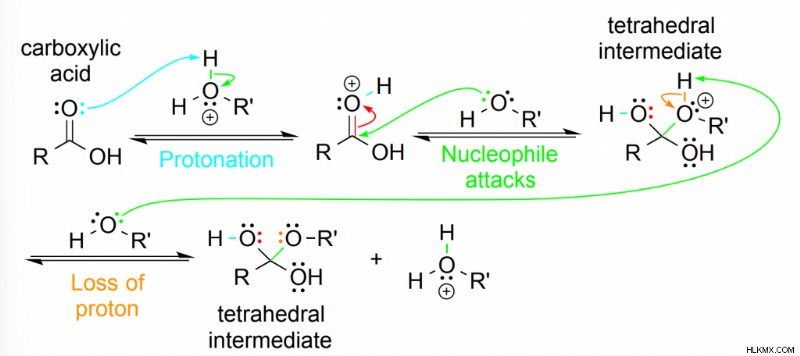
Μηχανισμός εστεροποίησης
- Πρώτον, η αντίδραση εστεροποίησης ξεκινά με την πρωτονίωση του καρβονυλικού οξυγόνου στο καρβοξυλικό οξύ. Το ιόν οξωνίου που δημιουργείται σταθεροποιείται με συντονισμό (η ικανότητα να μετακινούνται τα ηλεκτρόνια σε άλλο άτομο).
- Στη συνέχεια, η αλκοόλη επιτίθεται στον άνθρακα καρβονυλίου, ωθώντας τα ηλεκτρόνια στο οξυγόνο. Ως αποτέλεσμα, υπάρχει ο σχηματισμός ενός τετραεδρικού ενδιάμεσου.
- Έπειτα από αυτό, το ιόν οξωνίου του τετραεδρικού ενδιάμεσου χάνει ένα πρωτόνιο για να παράγει ένα ουδέτερο τετραεδρικό ενδιάμεσο.
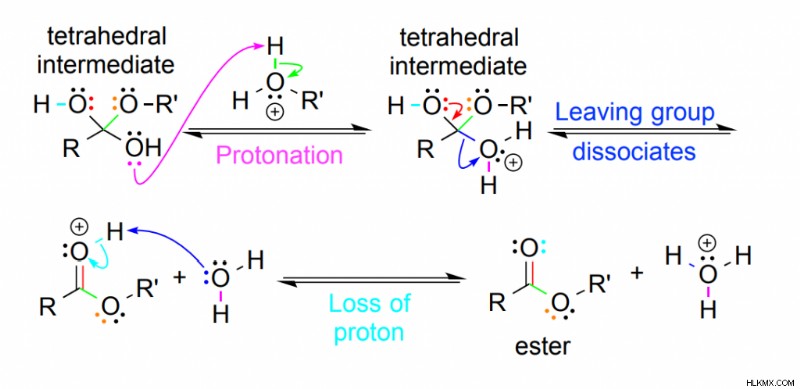
- Σε οποιαδήποτε από τις ομάδες υδροξυλίου, λαμβάνει χώρα πρωτονίωση και δημιουργεί μια καλή αποχωρούσα ομάδα (H2 O).
- Συνεπώς, το νερό διασπάται ως καλή αποχωρούσα ομάδα καθώς το καρβονύλιο επανασχηματίζεται.
- Τελευταία, ένα πρωτόνιο απορρίπτεται για να δώσει έναν ουδέτερο εστέρα ως προϊόν αντίδρασης.
Περαιτέρω ανάγνωση
- Λειτουργική ομάδα καρβοξυλικού οξέος
- Αντίδραση συμπύκνωσης Aldol
- Η αντίδραση ακυλίωσης Friedel-Crafts
- Williamson Ether Synthesis
- Λειτουργική ομάδα Amino