Εξέχοντα χαρακτηριστικά του επαγωγικού αποτελέσματος
Το επαγωγικό φαινόμενο, συχνά γνωστό ως "το φαινόμενο -I", είναι ένα φαινόμενο που καθιερώνεται με κενό στο οποίο η τιμολόγηση ενός χημικού δεσμού επηρεάζει τον προσανατολισμό των γειτονικών δεσμών σε ένα μόριο, με αποτέλεσμα έναν αιώνιο βασίλειο της πόλωσης.
Η πυκνότητα ηλεκτρονίων δεν είναι ομοιογενής όταν άτομα από δύο συστατικά δημιουργούν δεσμό. Τα νέφη ηλεκτρονίων σε έναν δεσμό προτιμούν να ευθυγραμμίζονται με τις πιο ηλεκτραρνητικές λεπτομέρειες του δεσμού. Πολλά μέρη των οργανικών αντιδράσεων μπορούν να εξηγηθούν χρησιμοποιώντας επαγωγικές συνέπειες. Οι ενώσεις που αφαιρούν ηλεκτρόνια, όπως –NO2, –CN, –CHO, –COOH, και τα αλογόνα που αντικαθίστανται σε έναν δακτύλιο βενζολίου, για παράδειγμα, μειώνουν την πυκνότητα ηλεκτρονίων στον δακτύλιο και τον καθιστούν πιο ευαίσθητο σε περαιτέρω (ηλεκτρόφιλη) υποκατάσταση.
Επαγωγική επίδραση στην οξύτητα και τη βασικότητα
Η ισορροπία ενός χημικού είδους και η οξύτητα ή η βασικότητά του επηρεάζονται από το επαγωγικό αποτέλεσμα. Τα ηλεκτροαρνητικά άτομα προσελκύουν ηλεκτρόνια προς τον εαυτό τους, επιτρέποντας τη σταθεροποίηση μιας συζυγούς βάσης. Το φαινόμενο -I μειώνει την πυκνότητα ηλεκτρονίων ενός μορίου, με αποτέλεσμα να γίνεται φτωχό σε ηλεκτρόνια και όξινο.
Λόγω της + επαγωγικής επίδρασης του ιδρύματος μεθυλίου που συνδέεται με έναν φορέα καρβοξυλικού οξέος, το μυρμηκικό οξύ (HCOOH ) είναι πιο όξινο από το οξικό οξύ (CH3COOH).
Τύποι επαγωγικών εφέ
Αρνητικό επαγωγικό αποτέλεσμα ή εφέ -I
Θετικό επαγωγικό αποτέλεσμα +Εφέ I
Αρνητικό επαγωγικό αποτέλεσμα (-I)
Η φύση της εξαγωγής ηλεκτρονίων των ατόμων αναφέρεται ως αρνητική επαγωγική επιρροή. Συμβολίζεται με το γράμμα -I. Οι εταιρείες στην πτωτική σειρά ως προς τον αντίκτυπό τους -I είναι οι εξής:
NH3+> NO2> CN> SO3H> CHO> CO> COOH> COCl> CONH2> F> Cl> Br> I> OH> OR> NH2> C6H5> H
Θετικό επαγωγικό αποτέλεσμα (-I)
Δηλώνεται με το γράμμα +I και αναφέρεται στην ικανότητα των εταιρειών ή των ατόμων να απελευθερώνουν ηλεκτρόνια. Οι εταιρείες με φθίνουσα σειρά με τη μεγαλύτερη επίδραση +I παρατίθενται παρακάτω.
C(CH3)3 –> CH(CH3)2 –> CH2CH3 -> CH3 –> H
Εξέχοντα χαρακτηριστικά του επαγωγικού αποτελέσματος
Συμβαίνει όταν η ηλεκτραρνητικότητα των ατόμων που συνθέτουν έναν δεσμό σίγμα ποικίλλει.
Οι δεσμοί Sigma χρησιμοποιούνται για να το μεταφέρουν. Δεν υπάρχουν δεσμοί pi που να ανησυχείτε.
Το μέγεθος της επαγωγικής πρόσκρουσης μειώνεται καθώς απομακρύνεστε περισσότερο από τους φορείς που τη δημιουργούν.
Πρόκειται για ένα εφέ που διαρκεί πολύ. Έχει την ικανότητα να δημιουργεί ένα μόνιμο δίπολο μέσα στο μόριο.
Το επαγωγικό αποτέλεσμα είναι πιο ευάλωτο και διέπεται από διάφορα φαινόμενα όπως συντονισμός, υπερσύζευξη κ.λπ.
Επηρεάζει τις χημικές και φυσικές ιδιότητες των υλικών.
Εφαρμογές επαγωγικού αποτελέσματος
-
Σταθερότητα των καρβοκατιόντων
Όταν τα φαινόμενα +I όπως το αλκύλιο δίνονται δίπλα σε αναμφισβήτητα φορτισμένο άνθρακα, η σταθερότητα των καρβοκατιόντων θα βελτιωθεί. Συνεισφέροντας στην πυκνότητα αρνητικού φορτίου μέσω μιας αποτελεσματικής επαγωγικής επίδρασης, οι εταιρείες +I μειώνουν το λεπτό φορτίο στον άνθρακα. Το καρβοκατιόν γίνεται πιο σταθερό ως αποτέλεσμα αυτού.
Το -I, από την άλλη πλευρά, αποσταθεροποιεί τα καρβοκατιόντα αυξάνοντας τον τεράστιο ρυθμό αφαιρώντας την πυκνότητα ηλεκτρονίων.
Λάβετε υπόψη ότι οποιοδήποτε ζήτημα αυξάνει τον ρυθμό (κακό ή καλό) σε ένα ιόν προκαλεί αποσταθεροποίηση, ενώ οποιοδήποτε ζήτημα μειώνει την τιμή προκαλεί σταθεροποίηση αυτού του ιόντος.
-
Σταθερότητα ελεύθερων ριζών
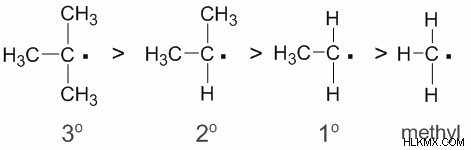
Με τον ίδιο τρόπο, η σταθερότητα των ελεύθερων ριζών αυξάνεται με την αύξηση στο ευρύ φάσμα των επιχειρήσεων αλκυλίου. Έτσι η σταθερότητα των διαφορετικών ελεύθερων ριζών είναι:
-
Σταθερότητα καρβανιών
Το φαινόμενο +I μειώνει τη σταθερότητα των καρβανιών, ενώ το φαινόμενο -I την ενισχύει.
Το αλκύλιο (+I), για παράδειγμα, μεταφέρει την πυκνότητα ηλεκτρονίων στον αρνητικά φορτισμένο άνθρακα, προκαλώντας αστάθεια του καρβανιόντος.
-
Αμίνες βασικής ισχύος
Η βασική ενέργεια των αμινών αυξάνεται όταν χρησιμοποιούνται ηλεκτρόνια όπως αλκυλομάδες. Ταυτόχρονα, η θεμελιώδης φύση μειώνεται όταν χρησιμοποιούνται επιχειρήσεις που υποχωρούν ηλεκτρονικά, όπως πρακτορεία αρυλίου. Ως αποτέλεσμα, οι αλκυλαμίνες είναι πιο αποτελεσματικές βάσεις Lewis από την αμμωνία, ενώ οι αρυλο αμίνες είναι λιγότερο αποτελεσματικές βάσεις Lewis.
Έτσι η σειρά της βασικής ισχύος των αλκυλ και αρυλ αμινών σε σχέση με την αμμωνία είναι CH3NH2> NH3> C6H5N
Συμπέρασμα
Το επαγωγικό αποτέλεσμα οφείλεται στη διαφορά στην ηλεκτραρνητικότητα των ατόμων που συνδέονται μεταξύ τους. Ένας δεσμός μεταξύ δύο ατόμων πολώνεται εάν υπάρχει διαφορά μεταξύ των ηλεκτραρνητικοτήτων τους. Αυτή η πόλωση του δεσμού οδηγεί στην εμφάνιση μερικών φορτίων + δ και − δ, τα οποία έχουν επίδραση στον γειτονικό δεσμό σε σχετικά μικρή απόσταση. Είναι επίσης γνωστό ότι αυτό το φαινόμενο δεν είναι πλέον ανιχνεύσιμο μετά από τέσσερις δεσμούς. Θα μπορούσε να είναι απώθηση ηλεκτρονίων (άτομα πιο ηλεκτραρνητικά από τον άνθρακα:O, N, F, κ.λπ.) ή απόσυρση ηλεκτρονίων (άτομα πιο ηλεκτραρνητικά από τον άνθρακα:O, N, F, κ.λπ.). (άτομα λιγότερο ηλεκτραρνητικά από τον άνθρακα:Mg, Al, κ.λπ.)