Αντιδράσεις δεύτερης τάξης
Οι αντιδράσεις δεύτερης τάξης είναι χημικές αντιδράσεις που εξαρτώνται από τις συγκεντρώσεις δύο αντιδραστηρίων πρώτης τάξης ή ένα αντιδραστήριο δεύτερης τάξης.
Επειδή οι αντιδράσεις δεύτερης τάξης μπορεί να είναι οποιοσδήποτε από τους δύο τύπους που περιγράφονται παραπάνω, οι ρυθμοί τους μπορούν να γενικευτούν ως ακολουθεί
r=k[A]x[B]y
Ρυθμός αντίδρασης :
Ας είναι μια αντίδραση – aA + bB cC + dD
Όσον αφορά τις συγκεντρώσεις των αντιδρώντων, ο ρυθμός αντίδρασης δεύτερης τάξης μπορεί να αναπαρασταθεί ως r=k[A ]x[B]y
Οι συγκεντρώσεις των αντιδρώντων [A] και [B] είναι σταθερές σε αυτήν την περίπτωση.
τα x και y είναι πειραματικά καθορισμένες τάξεις αντίδρασης, όχι οι στοιχειομετρικοί συντελεστές a και b.
Η σειρά μιας χημικής αντίδρασης καθορίζεται από το άθροισμα των μεταβλητών x και y. Μια αντίδραση δεύτερης τάξης είναι αυτή στην οποία x + y =2. Αυτό μπορεί να συμβεί εάν ένα αντιδρών καταναλώνεται με ρυθμό ανάλογο προς το τετράγωνο της συγκέντρωσής του (ρυθμός =k[A]2) ή εάν και τα δύο αντιδρώντα καταναλώνονται με ρυθμό ανάλογη της συγκέντρωσής τους στο τετράγωνο (rate =k[A][B]). Μια σταθερά ρυθμού διαδικασίας δεύτερης τάξης, k, μετριέται σε M-1s-1.
Μερικά παραδείγματα :
N2Ois διασπάται σε μονοξείδιο του αζώτου και οξυγόνο. Ακολουθεί μια απάντηση:
2N2O 2NO + O2
Τα ιόντα υδρογόνου και τα ιόντα υδροξυλίου αποτελούν το νερό.
H+ +OH– H2O
Παρουσία μιας βάσης, λαμβάνει χώρα υδρόλυση ενός εστέρα.
CH3COOC2H5 + NaOH CH3COONa + C2H5OH
Το ιωδιούχο υδρογόνο διασπάται σε δύο αέρια:υδρογόνο και ιώδιο.
2HI → H2+ I2
Διαφορική και ολοκληρωμένη εξίσωση ρυθμού για αντιδράσεις δεύτερης τάξης
Στην περίπτωση ενός αντιδραστηρίου δεύτερης τάξης που παράγει ένα συγκεκριμένο προϊόν σε μια χημική αντίδραση, ο νόμος διαφορικού ρυθμού η εξίσωση είναι η εξής:
-d[A]/dt =k[A]2
Για να προκύψει η εξίσωση του ολοκληρωτικού ποσοστού, αυτή η διαφορική μορφή πρέπει να αναδιαταχθεί ως εξής.
-d[A]/[A]2=-kdt
Μισή ζωή αυτών των αντιδράσεων :
Ο χρόνος ημιζωής μιας χημικής αντίδρασης είναι ο χρόνος που χρειάζεται για να μετακινηθεί το μισό της αρχικής ποσότητας αντιδραστηρίου μέσω της αντίδρασης. Ως αποτέλεσμα, κατά την προσπάθεια προσδιορισμού του χρόνου ημιζωής μιας αντίδρασης, πρέπει να γίνουν οι ακόλουθες αντικαταστάσεις:
R =[R]O2
Και
t =t12
Όταν αυτές οι τιμές αντικατασταθούν στην ολοκληρωτική μορφή της εξίσωσης ταχύτητας για αντιδράσεις δεύτερης τάξης, έχουμε:
1[R]02–1[R]0=kt1/2
Σαν αποτέλεσμα, η εξίσωση ημιζωής για αντιδράσεις δεύτερης τάξης μπορεί να εκφραστεί ως εξής.
t1/2=1k[R]0
Διαφορά μεταξύ αντιδράσεων πρώτης και δεύτερης τάξης :
Γράφημα αντίδρασης δεύτερης τάξης :
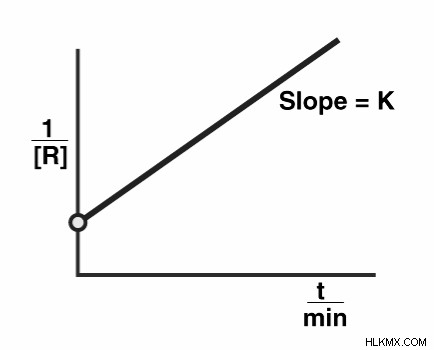
Συμπέρασμα :
Μια αντίδραση δεύτερης τάξης είναι ένας τύπος χημικής αντίδρασης στην οποία το αποτέλεσμα καθορίζεται από τις συγκεντρώσεις ένα αντιδραστήριο δεύτερης τάξης ή δύο αντιδραστήρια πρώτης τάξης. Σε μια αντίδραση δεύτερης τάξης, το σύνολο των εκθετών στον νόμο του ρυθμού ισούται με δύο.
r =k[A]x[B]y είναι ο ρυθμός των αντιδράσεων δεύτερης τάξης.




