Nature of The Reactants
Ο ρυθμός αντίδρασης αναφέρεται στην ταχύτητα που παίρνουν τα προϊόντα για να σχηματιστούν μέσω των αντιδρώντων όταν συμβαίνει μια χημική αντίδραση. Επιπλέον, παρέχει επίσης ουσιαστικές πληροφορίες για το χρονικό πλαίσιο που απαιτείται για την ολοκλήρωση μιας αντίδρασης. Για παράδειγμα, ο ρυθμός αντίδρασης της καύσης της κυτταρίνης στη φωτιά είναι πολύ υψηλότερος και η αντίδραση ολοκληρώνεται σε λιγότερο από ένα δευτερόλεπτο.
Ορισμός του ρυθμού αντίδρασης
Όπως αναφέρθηκε προηγουμένως, ο ρυθμός αντίδρασης καθορίζει την ταχύτητα που παίρνουν τα αντιδρώντα για να γίνουν προϊόντα. Ωστόσο, όταν εξετάζουμε μια χημική αντίδραση, ο ρυθμός αντίδρασής τους συνήθως ποικίλλει δραστικά. Αν και μερικές χημικές αντιδράσεις ολοκληρώνονται αμέσως, άλλες μπορεί να χρειαστούν παρατεταμένο χρονικό διάστημα για να ικανοποιήσουν την κατάσταση ισορροπίας.
Σύμφωνα με τον γενικό ορισμό του ρυθμού αντίδρασης, η καύση ξύλου διατηρεί έναν πιο σημαντικό ρυθμό αντίδρασης καθώς η διαδικασία είναι γρήγορη. Από την άλλη πλευρά, η διαδικασία σκουριάς του σιδήρου διατηρεί χαμηλό ρυθμό αντίδρασης καθώς είναι μια πιο αργή διαδικασία.
Παράγοντες που επηρεάζουν τον ρυθμό αντίδρασης
Πολλοί παράγοντες επηρεάζουν τον ρυθμό χημικής αντίδρασης. Μερικά από αυτά αναφέρονται παρακάτω:
- Συγκέντρωση αντιδρώντων
Καθώς η συγκέντρωση των αντιδρώντων που συμμετέχουν στη χημική αντίδραση αυξάνεται, ο αριθμός των συγκρούσεων ή των ενεργοποιημένων συγκρούσεων τείνει να αυξάνεται.
Αυτό, με τη σειρά του, ενισχύει τον ρυθμό μιας χημικής αντίδρασης. Αυτή η ιδέα βασίζεται στη θεωρία των συγκρούσεων, στην οποία ο αριθμός των συγκρούσεων αυξάνεται λόγω της αύξησης της συγκέντρωσης. Έτσι, μπορούμε να πούμε ότι ο ρυθμός της αντίδρασης είναι ευθέως ανάλογος με την αύξηση της συγκέντρωσης.
Δηλαδή, ρυθμός αντίδρασης ∝ συχνότητα σύγκρουσης (Z)
Τύπος =ρυθμός (r) ∝ cn ή r =kcn
Όπου r =ρυθμός της χημικής αντίδρασης
c =συγκέντρωση των αντιδρώντων
n =σειρά αντίδρασης
k =συγκεκριμένο ποσοστό
Πίεση
Όταν η πίεση σε ένα συγκεκριμένο αέριο σύστημα αυξάνεται, αυξάνει άμεσα τον αριθμό των συγκρούσεων που συμβαίνουν μεταξύ των αντιδρώντων ουσιών. Αυτό, με τη σειρά του, επηρεάζει το ρυθμό της αντίδρασης με θετικό τρόπο. Αυτό σημαίνει ότι ο ρυθμός αντίδρασης στον οποίο οι αντιδρώντες ουσίες είναι παρούσες σε αέρια μορφή αυξάνεται επίσης.
- Θερμοκρασία
Η θερμοκρασία είναι ο τρίτος παράγοντας που επηρεάζει τον ρυθμό των αντιδράσεων. Αυτό είναι λίγο περίπλοκο στην κατανόηση, καθώς υπάρχουν μερικές αντιδράσεις στις οποίες ο ρυθμός αντίδρασης αυξάνεται με την αύξηση της θερμοκρασίας.
Σε τέτοιες αντιδράσεις, οι ουσίες που αντιδρούν αποκτούν κινητική ενέργεια και ενεργοποιούνται περισσότερο. Αυτό, με τη σειρά του, αυξάνει τη σύγκρουση των αντιδρώντων ουσιών, αυξάνοντας τον ρυθμό μιας χημικής αντίδρασης.
Ωστόσο, αυτό δεν ισχύει σε κάθε περίπτωση. Ο ρυθμός των βιολογικών αντιδράσεων στις οποίες τα ένζυμα χρησιμοποιούνται ως καταλύτες είναι γνωστό ότι μειώνεται με την αύξηση της θερμοκρασίας. Ο λόγος είναι ότι τα ένζυμα χάνουν τη λειτουργία και τη δραστηριότητά τους λόγω της αύξησης της θερμοκρασίας.
- Παρουσία καταλύτη
Ο καταλύτης είναι μια ουσία που βοηθά την αντίδραση να ενισχύσει τον ρυθμό της αντίδρασης. Ένα πράγμα που πρέπει να θυμάστε είναι ότι ο ίδιος ο καταλύτης δεν συμμετέχει στην αντίδραση. Αυτό σημαίνει ότι βγαίνει με την ίδια μορφή με την οποία προστέθηκε.
Ένας καταλύτης παρέχει μια εναλλακτική διαδρομή για να λάβει χώρα η αντίδραση. Η νέα διαδρομή έχει χαμηλότερη ενέργεια ενεργοποίησης, που σημαίνει ότι τα αντιδρώντα μετατοπίζονται εύκολα σε προϊόντα.
Οι καταλύτες παίζουν σημαντικό ρόλο στις αναστρέψιμες αντιδράσεις. Είναι γνωστό ότι μειώνουν την ενέργεια ενεργοποίησης και των αντιδράσεων προς τα εμπρός και προς τα πίσω.
Ωστόσο, οι καταλύτες είναι δύο τύπων:θετικοί και αρνητικοί. Οι θετικοί καταλύτες είναι γνωστό ότι ενισχύουν τον ρυθμό αντίδρασης, ενώ οι αρνητικοί καταλύτες παρεμβαίνουν στην αντίδραση και τη μειώνουν.
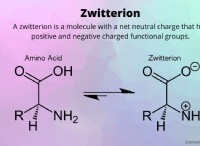
- Φύση των αντιδρώντων
Η φύση των αντιδρώντων είναι ένας άλλος παράγοντας που επηρεάζει τον ρυθμό των αντιδράσεων. Οι δύο τύποι δεσμών - ομοιοπολικός και ιοντικός - είναι γνωστό ότι προκαλούν διαφορετικούς ρυθμούς αντίδρασης.
Οι ιοντικές ενώσεις τείνουν να αντιδρούν πιο γρήγορα, επιτρέποντας την αύξηση του ρυθμού αντίδρασης. Εναλλακτικά, οι ομοιοπολικές ενώσεις είναι γνωστό ότι αντιδρούν αργά, επιτρέποντας τη μείωση του ρυθμού αντίδρασης. Ο λόγος είναι ότι στις ιοντικές ενώσεις λαμβάνει χώρα μόνο μεταφορά ιόντων. Αλλά από την άλλη πλευρά, οι ομοιοπολικές ενώσεις πρέπει να υποστούν διάσπαση δεσμού πριν σχηματίσουν προϊόντα.
- Προσανατολισμός των αντιδρώντων
Ο ρυθμός αντίδρασης εξαρτάται από τον προσανατολισμό στον οποίο τα αντιδρώντα αντιδρούν και σχηματίζουν προϊόντα. Εάν τα αντιδρώντα είναι παρόντα στον σωστό προσανατολισμό, θα οδηγήσει σε αυξημένο ρυθμό αντίδρασης.
Από την άλλη πλευρά, εάν ο προσανατολισμός του αντιδρώντος καθιστά αδύνατη την επίθεση, θα οδηγήσει σε μείωση του ρυθμού αντίδρασης.
Με άλλα λόγια, τα απλά αντιδρώντα έχουν υψηλότερο ρυθμό αντίδρασης σε σύγκριση με τα πολύπλοκα λόγω της μεγαλύτερης πιθανότητας σωστού προσανατολισμού.
Επιφάνεια
Το εμβαδόν επιφάνειας του αντιδρώντος σχετίζεται άμεσα με την αύξηση του ρυθμού αντίδρασης. Για να αυξηθεί ο ρυθμός αντίδρασης, τα αντιδρώντα και οι καταλύτες χρησιμοποιούνται σε μορφή λεπτής σκόνης. Αυτό αυξάνει το εμβαδόν της επιφάνειας των αντιδρώντων, το οποίο, με τη σειρά του, αυξάνει τον ρυθμό της αντίδρασης.
Για παράδειγμα, στις αντιδράσεις ψευδάργυρου και υδροχλωρικού, η ταχύτητα αντίδρασης αυξάνεται όταν ο ψευδάργυρος χρησιμοποιείται σε μορφή σκόνης σε σύγκριση με όταν ο ψευδάργυρος χρησιμοποιείται στη μορφή του σύρματος ψευδαργύρου.
- Ένταση φωτός
Ο μέσος ρυθμός αντίδρασης είναι ευθέως ανάλογος με την ένταση του φωτός. Όταν χρησιμοποιείται κατάλληλο φως, ο ρυθμός φωτοχημικής αντίδρασης αυξάνεται.
Με την αύξηση της έντασης του φωτός αυξάνεται και ο αριθμός των φωτονίων, γεγονός που αυξάνει και πάλι τον ρυθμό αντίδρασης.
Συμπέρασμα
Αυτοί λοιπόν είναι οι παράγοντες που επηρεάζουν τον ρυθμό των αντιδράσεων. Ωστόσο, η φύση των αντιδρώντων είναι ένας από τους πιο σημαντικούς παράγοντες που επηρεάζουν τον ρυθμό αντίδρασης και τη σειρά των αντιδράσεων.
Ένας από τους πιο συνηθισμένους τύπους αντιδράσεων στις οποίες ο ρυθμός αντίδρασης εξαρτάται μόνο από ένα αντιδρών είναι γνωστός ως αντίδραση πρώτης τάξης. Ωστόσο, υπάρχουν και άλλες αντιδράσεις τάξης:αντίδραση δεύτερης τάξης, αντίδραση τρίτης τάξης, αντίδραση ψευδο-πρώτης τάξης, και ούτω καθεξής.