Zwitterion Ορισμός και Παραδείγματα
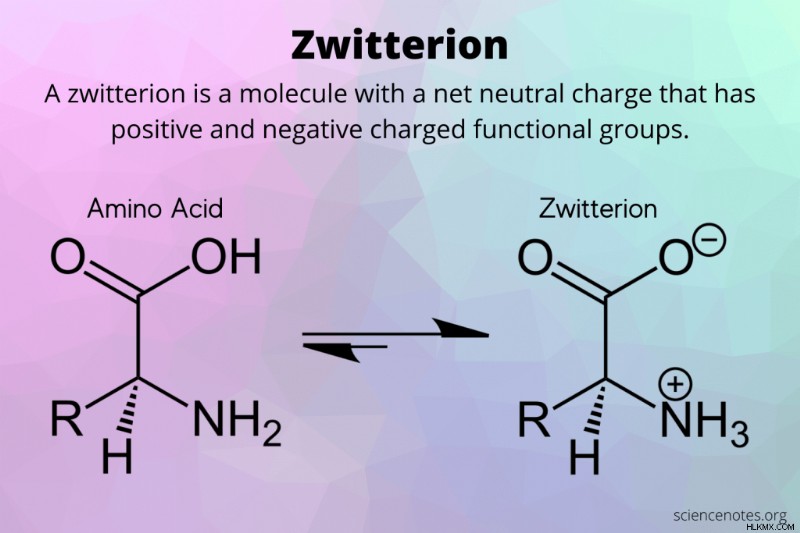
Στη χημεία, ένα αμφιτεριόν είναι ένα ουδέτερο μόριο που έχει ίσο αριθμό θετικών και αρνητικών φορτισμένων λειτουργικών ομάδων. Οι φορτισμένες λειτουργικές ομάδες συνδέονται με το υπόλοιπο μόριο με ομοιοπολικούς δεσμούς.
Ορισμός Zwitterion
Ο ορισμός του zwitterion προέρχεται από τη γερμανική λέξη Zwitter , που σημαίνει «υβρίδιο» ή «ερμαφρόδιτο». Το όνομα αντικατοπτρίζει ότι ένα αμφιτεριόν έχει ίσες περιοχές θετικού και αρνητικού ηλεκτρικού φορτίου. Μερικές φορές τα αμφισβητία ονομάζονται «εσωτερικά άλατα». Ωστόσο, αυτό το όνομα μπορεί να οδηγήσει σε σύγχυση επειδή τα άλατα περιέχουν ιοντικούς δεσμούς, ενώ τα αμφιτεριόντα περιέχουν ομοιοπολικούς δεσμούς.
Ορισμένα μόρια είναι αμφιτεριόντα μόνο εντός ορισμένων περιοχών pH. Άλλα μόρια υπάρχουν μόνο ως αμφιτεριόντα και δεν έχουν ποτέ αφόρτιστες λειτουργικές ομάδες. Αυτές οι ενώσεις ονομάζονται μόνιμα αμφιτεριόντα .
Παραδείγματα Zwitterions
- Αμινοξέα :Τα πιο γνωστά παραδείγματα αμφιτεριόντων είναι τα αμινοξέα. Ένα αμινοξύ έχει μια αμινομάδα και μια λειτουργική ομάδα καρβοξυλίου. Από μόνο του, ένα αμινοξύ δεν είναι αμφιτεριόν, αλλά σε υδατικό διάλυμα η αμινομάδα αποκτά πρωτόνιο (άτομο υδρογόνου) και έχει θετικό φορτίο, ενώ η καρβοξυλική ομάδα χάνει ένα πρωτόνιο και παίρνει αρνητικό φορτίο. Αυτό συμβαίνει σε μια αντίδραση ισομερισμού. Το αμφιτεριόν είναι συνολικά ουδέτερο, αλλά έχει ίσες και αντίθετες φορτισμένες λειτουργικές ομάδες. Σε ουδέτερο pH στο νερό, υπάρχει μια ισορροπία μεταξύ του «μητρικού» αμινοξέος και του αμφιτεριόντός του.
H2 N(R)CO2 H ↔ H3 N(R)CO2 + H2 Ο
Σε χαμηλό pH, το αμινοξύ σχηματίζει ένα κατιόν. Σε υψηλό pH, σχηματίζει ένα ανιόν. - Βεταΐνες :Οι βεταϊνες είναι μόνιμα αμφιτεριόντα. Παραδείγματα βεταϊνών είναι η τριμεθυλγλυκίνη και η κοκαμιδοπροπυλ βεταΐνη.
- Σουλφαμικό οξύ :Όπως τα αμινοξέα, το σουλφαμικό οξύ υπάρχει σε μια εντελώς ουδέτερη μορφή και μια μορφή αμφιτεριόντων. Το σουλφαμικό οξύ κρυσταλλώνεται στη μορφή αμφιτεριόντων του.
- Ανθρανιλικό οξύ :Οι κρύσταλλοι του ανθρανιλικού οξέος περιέχουν ίσες ποσότητες από το μητρικό μόριο και το αμφιτεριόν.
- Ψιλοκυβίνη
- Φωσφατιδυλοχολίνη
Τι είναι Δεν ένα Zwitterion;
Για να κατανοήσουμε τι είναι τα αμφιτεριόντα, βοηθάει να δούμε παραδείγματα για το τι δεν είναι. Τα μόρια που έχουν περιοχές μερικού φορτίου δεν είναι αμφιτεριόντα. Τα άλατα δεν είναι αμφιτεριόντα. Παραδείγματα ενώσεων που δεν είναι αμφιτεριόντα περιλαμβάνουν:
- Νερό (H2 Ο) :Αν και το νερό είναι μια ουδέτερη ομοιοπολική ένωση, τα άτομα υδρογόνου και οξυγόνου είναι περιοχές με μερικό μόνο φορτίο. Το νερό αυτοδιαχωρίζεται και σχηματίζει ξεχωριστά ιόντα υδρονίου και υδροξειδίου.
- Χλωριούχο νάτριο (NaCl) :Το χλωριούχο νάτριο και άλλα άλατα δεν είναι αμφιτεριόντα γιατί συνδέονται με ιοντικούς δεσμούς. Επιπλέον, διασπώνται στο νερό αντί να σχηματίζουν μόρια με περιοχές θετικού και αρνητικού φορτίου.
- Χλωριούχο αμμώνιο (NH4 Cl) :Το χλωριούχο αμμώνιο περιέχει ομοιοπολικούς δεσμούς εντός του κατιόντος αμμωνίου, αλλά το αμμώνιο συνδέεται με το χλωρίδιο μέσω ιοντικών δεσμών. Το χλωριούχο αμμώνιο διασπάται στο νερό αντί να σχηματίζει ένα ουδέτερο μόριο με φορτισμένες περιοχές.
Ιδιότητες Zwitterion
Τα Zwitterions εμφανίζουν ορισμένες ιδιότητες:
- Ένα αμφιτεριόν είναι ουδέτερο, αλλά έχει θετικές και αρνητικές περιοχές φορτίου.
- Τα αμφιτεριόντα περιέχουν ομοιοπολικούς δεσμούς.
- Πολλοί σχηματίζονται από αμφολύτες που έχουν τόσο όξινες όσο και βασικές λειτουργικές ομάδες.
- Τα αμφιτεριόντα τείνουν να έχουν υψηλότερα σημεία τήξης από άλλα μόρια ίδιου μεγέθους. Οι φορτισμένες περιοχές προσελκύουν έντονα άλλα μόρια, επομένως χρειάζεται περισσότερη ενέργεια για να διαχωριστούν.
- Ένα αμφιτεριόν όπως ένα αμινοξύ έχει ισοηλεκτρικό σημείο (pI). Αυτή είναι η τιμή του pH όπου το μόριο έχει ουδέτερο φορτίο.
Σημασία των Zwitterions
Τα Zwitterions έχουν σημαντικές χρήσεις εμπορικά και στη φύση:
- Βιοχημεία :Για παράδειγμα, η φωσφατιδυλοχολίνη είναι ένα φωσφολιπίδιο που είναι σημαντικό συστατικό των κυτταρικών μεμβρανών. Οι φορτισμένες περιοχές δίνουν στο μόριο υδρόφοβες και υδρόφιλες ιδιότητες.
- Φάρμακα και συμπληρώματα :Πολλά αλκαλοειδή είναι αμφιτεριόντα. Η φαρμακολογία τους εξαρτάται από τις ιδιότητές τους. Ορισμένα συμπληρώματα, όπως η L-λυσίνη, είναι αμφιτεριόντα. Τα αμφιτερόνια είναι σημαντικά σε αισθητήρες και ιατρικά εμφυτεύματα.
- Απομονωτές :Ορισμένα buffers είναι διπολικά, όπως τα MOPS και HEPES. Αυτά τα ρυθμιστικά διαλύματα δεν διαπερνούν τις κυτταρικές μεμβράνες.
- Μοριακή βιολογία :Τα αμφιτεριόντα βρίσκουν χρήση στο SDS PAGE (ηλεκτροφόρηση γέλης δωδεκυλοθειικού νατρίου-πολυακρυλαμιδίου). Η κύρια χρήση εδώ είναι για διαχωρισμό πρωτεϊνών.
- Επικαλύψεις :Τα αμφιτεριόντα βοηθούν στην πρόληψη της καθίζησης βακτηρίων και άλλων οργανισμών στις επιφάνειες. Τέτοιες επικαλύψεις υπάρχουν στην ιατρική και τη ναυτιλιακή βιομηχανία.
Αναφορές
- Jensen, Jan H.; Gordon, Mark S. (1995). «Σχετικά με τον αριθμό των μορίων νερού που είναι απαραίτητα για τη σταθεροποίηση του γλυκίνης Zwitterion». Journal of the American Chemical Society . 117 (31):8159–8170. doi:10.1021/ja00136a013
- Nelson, D. L.; Cox, M. M. (2000). Lehninger, Principles of Biochemistry (3η έκδ.). Νέα Υόρκη:Worth Publishing. ISBN 1-57259-153-6.
- Τιμή, William D.; Jockusch, Rebecca A.; Williams, Evan R. (1997). «Είναι η αργινίνη ένα Zwitterion στη φάση του αερίου;». Journal of the American Chemical Society . 119 (49):11988–11989. doi:10.1021/ja9711627. PMC 1364450
- Skoog, Douglas, A.; West, Donald M.; Holler, F. James; Crouch, Stanley R. (2004). Βασικές αρχές της Αναλυτικής Χημείας (8η έκδ.). Τόμσον/Μπρουκς/Κόουλ. ISBN 0-03-035523-0.




