Stereogenic Center vs Chiral Center
Κύρια διαφορά – Στερεογονικό κέντρο έναντι Χειρικό Κέντρο
Το στερεογενές κέντρο και το χειρικό κέντρο είναι δύο όροι που χρησιμοποιούνται για να εξηγήσουν το στερεοϊσομερισμό στην οργανική χημεία. Αυτοί οι δύο όροι συχνά θεωρούνται ίδιοι, αλλά υπάρχει διαφορά μεταξύ στερεογενούς κέντρου και χειρόμορφου κέντρου. Όλα τα χειρόμορφα κέντρα είναι στερεογονικά κέντρα, αλλά όλα τα στερεογονικά κέντρα δεν είναι χειρόμορφα κέντρα. Είναι σημαντικό να γνωρίζουμε τη διαφορά μεταξύ στερεογονικού κέντρου και χειρόμορφου κέντρου, καθώς η παρουσία αυτών των κέντρων είναι που δημιουργεί ένα στερεοϊσομερές.
Βασικές περιοχές που καλύπτονται
1. Τι είναι ένα Στερεογονικό Κέντρο
– Ορισμός, Χαρακτηριστικά
2. Τι είναι το Χειρικό Κέντρο
– Ορισμός, Χαρακτηριστικά
3. Stereogenic Center vs Chiral Center
3.1. Ομοιότητες μεταξύ του Stereogenic Center και του Chiral Center
– Περίληψη των Κοινών Χαρακτηριστικών
3.2. Διαφορά μεταξύ Στερεογονικού και Χειρικού Κέντρου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Χειρικότητα, Χειρικό Κέντρο, Ισομερή, Υβριδισμός, Στερεοϊσομερισμός, Στερεογονικό Κέντρο 
Τι είναι το Stereogenic Center
Στερεογενές κέντρο είναι κάθε άτομο που δίνει διαφορετικά ισομερή όταν ανταλλάσσονται άτομα ή ομάδες που συνδέονται με αυτό. Αυτά τα ισομερή ονομάζονται στερεοϊσομερή επειδή οι δομές των μορίων είναι ίδιες αλλά οι χωρικές τους διατάξεις είναι διαφορετικές μεταξύ τους. Με άλλα λόγια, τα στερεοϊσομερή διαφέρουν μεταξύ τους μόνο στην τρισδιάστατη διάταξη τους.
Το άτομο που είναι το στερεογονικό κέντρο μπορεί να είναι είτε sp είτε sp υβριδοποιημένο. Αυτό σημαίνει ότι μπορεί να έχει είτε διπλούς δεσμούς είτε απλούς δεσμούς. Τα αχειρόμορφα μόρια μπορεί μερικές φορές να έχουν επίσης στερεογονικά κέντρα. Επομένως, όλα τα χειρόμορφα κέντρα είναι στερεογονικά κέντρα. Αλλά ένα στερεογονικό κέντρο δεν είναι ουσιαστικά ένα χειρόμορφο κέντρο. Ένα καλό παράδειγμα για αυτό είναι το cis –trans γεωμετρία.
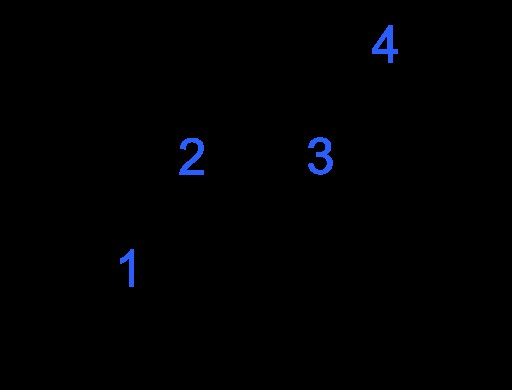
Εικόνα 1:trans-2-βουτένιο
Η παραπάνω εικόνα δείχνει ένα trans –2 -μόριο βουτενίου. Δεν έχει χειρικό κέντρο. Έχει όμως στερεογονικό κέντρο. Μεταξύ των ατόμων άνθρακα, τόσο τα 2 όσο και τα 3 άτομα άνθρακα είναι στερεογονικά κέντρα επειδή οι δύο ομάδες που συνδέονται με τα άτομα άνθρακα είναι –H και –CH3 και αυτές οι ομάδες μπορούν να ανταλλάσσονται προκειμένου να ληφθεί ένα νέο μόριο, το οποίο είναι το στερεοϊσομερές αυτού του μορίου. Το νέο μόριο είναι το cis –2 -βουτένιο.
Τι είναι ένα Chiral Center
Ένα χειρόμορφο κέντρο είναι ένα άτομο άνθρακα που συνδέεται άμεσα με τέσσερις διαφορετικές ομάδες. Ένα μόριο με χειρόμορφο κέντρο δεν μπορεί να υπερτεθεί με την κατοπτρική του εικόνα. Για το λόγο αυτό, το μόριο και η κατοπτρική εικόνα θεωρούνται ως δύο διαφορετικά μόρια. Το άτομο άνθρακα είναι πάντα σφυβριδισμένο έτσι ώστε να μπορεί να προσκολληθεί σε τέσσερις ομάδες.
Επομένως, ένα μόριο με χειρόμορφο κέντρο μπορεί πάντα να δημιουργήσει ένα στερεοϊσομερές και ένα χειρικό κέντρο είναι πάντα ένα στερεογονικό κέντρο. Ένα μόνο μόριο μπορεί να έχει περισσότερα από ένα χειρόμορφα κέντρα.
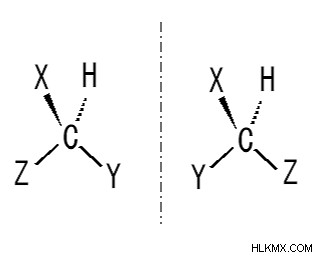
Εικόνα 2:Ένα μόριο που έχει χειρικό κέντρο
Η παραπάνω εικόνα δείχνει ένα άτομο άνθρακα συνδεδεμένο με ένα άτομο υδρογόνου (Η) μαζί με τρεις άλλες ομάδες, οι οποίες είναι διαφορετικές μεταξύ τους. (Χ, Υ, Ζ). Εκεί, το άτομο άνθρακα είναι ένα χειρόμορφο κέντρο. Είναι sp υβριδοποιημένο και προσαρτάται σε τέσσερις διαφορετικές ομάδες. Το κατοπτρικό είδωλό του δεν μπορεί να υπερτεθεί με το μόριο.
Στερεογενές Κέντρο εναντίον Χειρικό Κέντρο
Ομοιότητες μεταξύ Stereogenic Center και Chiral Center
- Η παρουσία ενός στερεογονικού κέντρου ή ενός χειρόμορφου κέντρου δημιουργεί ένα στερεοϊσομερές.
- Τα χειρομορφικά κέντρα είναι πάντα στερεογονικά κέντρα, αλλά όλα τα στερεογονικά κέντρα δεν είναι χειρόμορφα κέντρα.
Difference Between Stereogenic and Chiral Center
Ορισμός
Στερεογονικό Κέντρο: Στερεογονικό κέντρο είναι κάθε άτομο που δίνει διαφορετικά ισομερή όταν ανταλλάσσονται άτομα ή ομάδες που συνδέονται με αυτό.
Chiral Center: Ένα χειρόμορφο κέντρο είναι ένα άτομο που συνδέεται άμεσα με τέσσερις διαφορετικές ομάδες.
Υβριδισμός
Στερεογονικό Κέντρο: Το άτομο άνθρακα μπορεί να είναι είτε sp είτε σπυβριδισμένο στο στερεογονικό κέντρο.
Chiral Center: Το άτομο άνθρακα είναι πάντα υβριδισμένο sp στο χειρόμορφο κέντρο.
Αριθμός Ομάδων
Στερεογονικό Κέντρο: Το στερεογονικό κέντρο μπορεί να συνδεθεί σε τρεις ή τέσσερις ομάδες.
Chiral Center: Το χειρόμορφο κέντρο έχει πάντα τέσσερις ομάδες.
Ομόλογα
Στερεογονικό Κέντρο: Το στερεογονικό κέντρο μπορεί να έχει είτε απλούς δεσμούς είτε διπλούς δεσμούς.
Chiral Center: Τα χειραλικά κέντρα έχουν μόνο απλούς δεσμούς.
Χειρικότητα
Στερεογονικό Κέντρο: Τα στερεογονικά κέντρα μπορούν να βρεθούν είτε σε χειρόμορφα μόρια είτε σε μη χειρόμορφα μόρια.
Chiral Center: Τα χειρόμορφα κέντρα βρίσκονται μόνο σε χειρόμορφα μόρια.
Ανταλλαγή Ομάδων
Στερεογονικό κέντρο: Ορισμένα μόρια με στερεογονικά κέντρα δίνουν στερεοϊσομερή όταν ανταλλάσσονται οι συνδεδεμένες ομάδες. (π.χ.:cis-trans ισομερή)
Chiral Center: Τα μόρια που έχουν χειρόμορφα κέντρα δεν παρουσιάζουν διαφορά όταν ανταλλάσσονται συνδεδεμένες ομάδες.
Συμπέρασμα
Όλα τα χειρόμορφα κέντρα είναι στερεογονικά κέντρα, αλλά όλα τα στερεογονικά κέντρα δεν είναι χειρόμορφα κέντρα. Υπάρχουν πολλά διακριτά χαρακτηριστικά που μπορούν να χρησιμοποιηθούν για τον εντοπισμό της διαφοράς μεταξύ στερεογονικού κέντρου και χειρομορφικού κέντρου.




