Διαφορά μεταξύ κυψελών Daniell και γαλβανικού κυττάρου
Κύρια διαφορά – Κύτταρο Danielll εναντίον Γαλβανικού Κυττάρου
Ένα ηλεκτροχημικό στοιχείο είναι μια συσκευή που είναι ικανή να παράγει ηλεκτρική ενέργεια από χημικές αντιδράσεις ή να διευκολύνει μια χημική αντίδραση με ηλεκτρισμό. Αυτά τα κύτταρα αποτελούνται από δύο μισά κύτταρα. Υπάρχει ένα ηλεκτρόδιο και ένας ηλεκτρολύτης ανά μισό στοιχείο. Μερικές φορές και τα δύο ηλεκτρόδια τοποθετούνται στο ίδιο δοχείο, αλλά οι δύο ηλεκτρολύτες διαχωρίζονται μέσω ενός πορώδους φραγμού. Η κυψέλη Daniell και η γαλβανική κυψέλη είναι παραδείγματα ηλεκτροχημικών στοιχείων. Ένα στοιχείο Daniell είναι ένας τύπος ηλεκτροχημικού στοιχείου που αποτελείται από ηλεκτρόδια χαλκού και ψευδαργύρου. Ένα γαλβανικό στοιχείο είναι ένα ηλεκτροχημικό στοιχείο που χρησιμοποιεί ηλεκτρική ενέργεια που παράγεται από αυθόρμητες αντιδράσεις οξειδοαναγωγής. Η κύρια διαφορά μεταξύ του στοιχείου Danielll και του γαλβανικού στοιχείου είναι ότι Το στοιχείο Daniell χρησιμοποιεί μόνο χαλκό και ψευδάργυρο ως ηλεκτρόδια, ενώ ένα γαλβανικό στοιχείο μπορεί να έχει μια ποικιλία μετάλλων ως ηλεκτρόδια.
Βασικές περιοχές που καλύπτονται
1. Τι είναι ένα κύτταρο Daniell
– Ορισμός, πώς λειτουργεί
2. Τι είναι το Γαλβανικό Κύτταρο
– Ορισμός, πώς λειτουργεί
3. Ποιες είναι οι ομοιότητες μεταξύ Danielll Cell και Galvanic Cell
– Περίληψη κοινών χαρακτηριστικών
4. Ποια είναι η διαφορά μεταξύ του κυττάρου Daniell και του γαλβανικού κυττάρου
– Σύγκριση βασικών διαφορών
Βασικοί όροι:Χαλκός, Κυψέλη Daniell, Ηλεκτροχημική Κυψέλη, Ηλεκτρόδιο, Ηλεκτρολύτης, Γαλβανική Κυψέλη, Ημικύτταρο, Οξείδωση, Αντιδράσεις Οξειδοαναγωγής, Αναγωγή, Βολταϊκό Κύτταρο, Ψευδάργυρος

Τι είναι ένα κύτταρο Daniell
Το στοιχείο Daniell είναι ένας τύπος ηλεκτροχημικού στοιχείου που αποτελείται από ένα ηλεκτρόδιο χαλκού και ένα ηλεκτρόδιο ψευδαργύρου βυθισμένο σε θειικό χαλκό (II) και θειικό ψευδάργυρο, αντίστοιχα. Επομένως, αυτό το στοιχείο χρησιμοποιεί δύο ηλεκτρολύτες. Ένας ηλεκτρολύτης είναι μια ουσία που μπορεί να διαχωριστεί σε ιόντα όταν διαλυθεί στο νερό. Αυτά τα ιόντα είναι ικανά να μεταφέρουν ηλεκτρισμό μέσω του υδατικού διαλύματος αυτής της ουσίας.
Το μισό στοιχείο του στοιχείου Daniell αποτελείται από ένα ηλεκτρόδιο χαλκού βυθισμένο σε διάλυμα θειικού χαλκού (II) και το άλλο μισό στοιχείο αποτελείται από ένα ηλεκτρόδιο ψευδαργύρου βυθισμένο σε ψευδάργυρο θειικό διάλυμα. Υπάρχει μια αντίδραση οξειδοαναγωγής που παρέχει ηλεκτρόνια για ηλεκτρική αγωγιμότητα. Ως άνοδος χρησιμοποιείται ψευδάργυρος. Ο χαλκός είναι η κάθοδος. Οι δύο μισές αντιδράσεις δίνονται παρακάτω.
Άνοδος : Zn(ες) → Zn(aq) + 2e
Κάθοδος :Cu(aq) + 2e → Cu(s)
Στην άνοδο, ο ψευδάργυρος οξειδώνεται σε ιόν ψευδαργύρου (II). Στην κάθοδο, το ιόν χαλκού (II) ανάγεται σε χαλκό. Η συνολική αντίδραση μπορεί να δοθεί όπως παρακάτω.
Zn(s) + Cu(aq) → Zn(aq) + Cu(s)
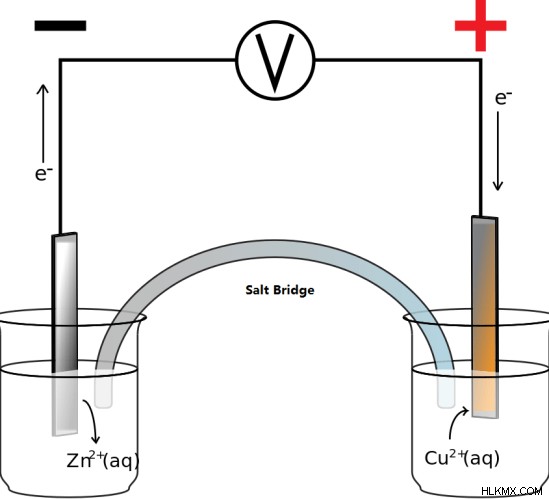
Εικόνα 1:Σχηματικό διάγραμμα του κυττάρου Daniell
Για την εύκολη επίδειξη του στοιχείου, οι δύο ηλεκτρολύτες διαχωρίζονται μεταξύ τους και χρησιμοποιείται μια γέφυρα αλατιού για την κίνηση των ιόντων. Η γέφυρα αλατιού είναι γεμάτη με μια ένωση που δεν παρεμβαίνει στην αντίδραση οξειδοαναγωγής που λαμβάνει χώρα στο κύτταρο. Αλλά σε μια πραγματική κυψέλη Danielll, χρησιμοποιείται ένα πορώδες φράγμα για τον διαχωρισμό των δύο ηλεκτρολυτικών διαλυμάτων. Αυτό το πορώδες φράγμα δεν μπορεί να ελέγξει την κίνηση των ιόντων χαλκού στο θειικό ψευδάργυρο και αντίστροφα. Αυτό καθιστά αδύνατη την επαναφόρτιση.
Τι είναι ένα Galvanic Cell
Το γαλβανικό στοιχείο είναι ένας τύπος ηλεκτροχημικού στοιχείου που χρησιμοποιεί αυθόρμητες αντιδράσεις οξειδοαναγωγής για την παραγωγή ηλεκτρικής ενέργειας. Αυτό ονομάζεται επίσης βολταϊκό στοιχείο . Το κύτταρο αποτελείται από δύο μισά κύτταρα. Κάθε μισό στοιχείο αποτελείται από ένα ηλεκτρόδιο και έναν ηλεκτρολύτη. Το ηλεκτρόδιο βυθίζεται στο ηλεκτρολυτικό διάλυμα. Μερικές φορές αυτοί οι ηλεκτρολύτες είναι εντελώς ξεχωριστοί, αλλά άλλες φορές χωρίζονται μόνο από ένα πορώδες φράγμα. Όταν οι ηλεκτρολύτες διαχωριστούν πλήρως, χρησιμοποιείται μια γέφυρα αλατιού για τη διατήρηση της κίνησης των ιόντων μεταξύ των δύο ηλεκτρολυτών.
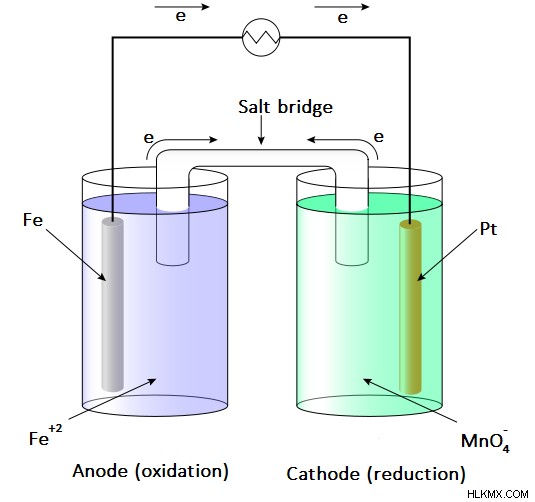
Εικόνα 2:Παράδειγμα γαλβανικού κυττάρου
Τα ηλεκτρόδια και οι ηλεκτρολύτες επιλέγονται λαμβάνοντας υπόψη αν είναι αυθόρμητα ή όχι. Αυτό μπορεί να βρεθεί θεωρητικά με τον υπολογισμό των δυναμικών ηλεκτροδίων κάθε μισού στοιχείου. Ωστόσο, το ένα μισό κύτταρο θα πρέπει να παρουσιάζει οξείδωση ενώ το άλλο μισό κύτταρο θα πρέπει να παρουσιάζει αντίδραση αναγωγής. Η οξείδωση συμβαίνει στην άνοδο ενώ η αναγωγή στην κάθοδο. Δεδομένου ότι ένα γαλβανικό (βολταϊκό) στοιχείο χρησιμοποιεί την ενέργεια που απελευθερώνεται κατά τη διάρκεια μιας αυθόρμητης αντίδρασης οξειδοαναγωγής για να παράγει ηλεκτρική ενέργεια, τα γαλβανικά στοιχεία χρησιμοποιούνται ως πηγές ηλεκτρικής ενέργειας. Παράγουν συνεχές ρεύμα.
Similarities Between Daniell Cell and Galvanic Cell
- Και τα δύο είναι παραδείγματα ηλεκτρολυτικών στοιχείων.
- Και τα δύο αποτελούνται από μισά κύτταρα που αποτελούνται από ηλεκτρόδια και ηλεκτρολύτες.
- Οι ηλεκτρολύτες μπορούν είτε να διαχωριστούν εντελώς είτε να διαχωριστούν από μια πορώδη μεμβράνη.
Διαφορά μεταξύ κυψελών Daniell και γαλβανικού κυττάρου
Ορισμός
Daniell Cell: Το στοιχείο Daniell είναι ένας τύπος ηλεκτροχημικού στοιχείου που αποτελείται από ένα ηλεκτρόδιο χαλκού και ένα ηλεκτρόδιο ψευδαργύρου βυθισμένο σε θειικό χαλκό(II) και θειικό ψευδάργυρο αντίστοιχα.
Γαλβανικό στοιχείο: Το γαλβανικό στοιχείο είναι ένας τύπος ηλεκτροχημικού στοιχείου που χρησιμοποιεί αυθόρμητες αντιδράσεις οξειδοαναγωγής για την παραγωγή ηλεκτρικής ενέργειας.
Άνοδος
Daniell Cell: Η άνοδος του κυττάρου Daniell είναι ένα ηλεκτρόδιο ψευδαργύρου.
Γαλβανικό στοιχείο: Η άνοδος του γαλβανικού στοιχείου είναι ένα μέταλλο που μπορεί να οξειδωθεί.
Κάθοδος
Daniell Cell: Η κάθοδος του κυττάρου Danielll είναι ένα ηλεκτρόδιο χαλκού.
Γαλβανικό στοιχείο: Η κάθοδος του γαλβανικού στοιχείου είναι ένα μέταλλο που μπορεί να αναχθεί.
Ηλεκτρολύτες
Daniell Cell: Οι ηλεκτρολύτες που χρησιμοποιούνται για το στοιχείο Daniell είναι θειικός χαλκός(II) και θειικός ψευδάργυρος.
Γαλβανικό στοιχείο: Οι ηλεκτρολύτες που χρησιμοποιούνται για το γαλβανικό στοιχείο είναι τα άλατα των μετάλλων κάθε ηλεκτροδίου.
Συμπέρασμα
Τόσο το στοιχείο Danielll όσο και το γαλβανικό στοιχείο είναι ηλεκτροχημικά στοιχεία. Αυτά τα κύτταρα χρησιμοποιούν αυθόρμητες αντιδράσεις οξειδοαναγωγής για την παραγωγή ηλεκτρικής ενέργειας. Αυτή η παραγόμενη ενέργεια μπορεί να χρησιμοποιηθεί για μια εξωτερική εργασία που πρέπει να γίνει. Η βασική διαφορά μεταξύ του στοιχείου Danielll και του γαλβανικού στοιχείου είναι ότι το στοιχείο Daniell χρησιμοποιεί μόνο χαλκό και ψευδάργυρο ως ηλεκτρόδια, ενώ ένα γαλβανικό στοιχείο μπορεί να έχει μια ποικιλία μετάλλων ως ηλεκτρόδια.




