Αλκυλίωση
Η αλκυλίωση είναι μια χημική διαδικασία μέσω της οποίας μια ομάδα αλκυλίου συνδέεται με κάποιο μόριο οργανικού υποστρώματος με μεθόδους όπως η προσθήκη και η υποκατάσταση. Η ομάδα αλκυλίου είναι ένα αλκάνιο που του λείπει ένα άτομο υδρογόνου. Μια μεθυλομάδα είναι η απλούστερη αλκυλομάδα που αποτελείται από ένα άτομο άνθρακα και τρία άτομα υδρογόνου. Η αλκυλίωση λαμβάνει χώρα παρουσία ισχυρού ανόργανου οξέος ή οξέος λουβίς, όπως οξείδια μετάλλων, με τη χρήση ηλεκτρόφιλων αλκυλιωτικών παραγόντων όπως η ολεφίνη και το αλκυλαλογονίδιο. Στην περίπτωση των αρωματικών ενώσεων, η αλκυλίωση οδηγεί στην προσθήκη κάποιων απλών αλυσίδων άνθρακα στον δακτύλιο βενζολίου. Υπάρχει μια διαδικασία αντίθεσης με την αλκυλίωση γνωστή ως αποαλκυλίωση, η οποία περιλαμβάνει την απομάκρυνση της αλκυλομάδας από μια ένωση. Υπάρχουν διάφοροι τύποι αλκυλιωτικών παραγόντων και υπάρχουν πολλές χρήσεις της αλκυλίωσης όχι μόνο στην οργανική χημεία αλλά και στον τομέα της βιολογίας.
Τύποι αλκυλιωτικών παραγόντων
-
Πυρηνόφιλοι αλκυλιωτικοί παράγοντες :
Οι πυρηνόφιλοι αλκυλιωτικοί παράγοντες σχηματίζουν ένα είδος που ονομάζεται καρβανιόν. Αυτοί οι αλκυλιωτικοί παράγοντες εκτοπίζουν υποκατάστατα αλογονιδίου στο δεδομένο άτομο άνθρακα μέσω ενός μηχανισμού SN2. Ένα από τα πιο κοινά παραδείγματα αντίδρασης που περιλαμβάνει πυρηνόφιλους αλκυλιωτικούς παράγοντες είναι η «σύζευξη Suzuki», η οποία περιλαμβάνει μετατόπιση μιας ομάδας αλογονιδίου από την ένωση. Παραδείγματα πυρηνόφιλων αλκυλιωτικών παραγόντων είναι τα αντιδραστήρια grignard και μερικές ακόμη οργανομεταλλικές ενώσεις.
-
Ακυλίωση με ηλεκτροφιλικούς αλκυλιωτικούς παράγοντες :
Ηλεκτρόφιλοι αλκυλιωτικοί παράγοντες παράγουν καρβοκατιόν, το οποίο είναι επίσης ισοδύναμο με ένα κατιόν αλκυλίου. Αυτή η ομάδα αλκυλιωτικού παράγοντα περιλαμβάνει αλκυλαλογονίδια όπως το τριμεθυλοξόνιο και το τετραφθοροβορικό λόγω του φανερού θετικού φορτίου και της αδρανούς αποχωρούσας ομάδας τους. Οι καταλύτες που χρησιμοποιούνται για αυτή την αλκυλίωση είναι το οξύ γουίς και το βρονσμένο οξύ. Τα οξέα Lewis όπως το τριχλωριούχο αλουμίνιο. Τα οξέα Lewis χρησιμοποιούνται συνήθως όταν χρησιμοποιούνται αλκυλαλογονίδια. Τα οξέα Bronsted χρησιμοποιούνται σε περίπτωση που γίνεται αλκυλίωση με ολεφίνες. Μερικοί πιο συνηθισμένοι καταλύτες είναι οι ζεόλιθοι.
Υπάρχουν αρκετοί κίνδυνοι από τη χρήση ηλεκτρόφιλων αλκυλιωτικών παραγόντων, επειδή αυτός ο τύπος αλκυλιωτικού παράγοντα είναι τοξικός και καρκινογόνος και τείνει να αλκυλιώνει το DNA. Κατά συνέπεια, το DNA αντιμετωπίζει προβλήματα περιέλιξης επειδή το αλκυλιωμένο DNA δεν περιτυλίσσεται ή ξετυλίγεται σωστά ή δεν μπορεί να υποστεί επεξεργασία από τα συγκεκριμένα ένζυμα που χρησιμοποιούνται για την αποκωδικοποίηση πληροφοριών. Η πιο ευρέως χρησιμοποιούμενη αντίδραση αλκυλίωσης είναι η αντίδραση αλκυλίωσης Friedel Crafts.
Αντίδραση αλκυλίωσης Friedel Crafts
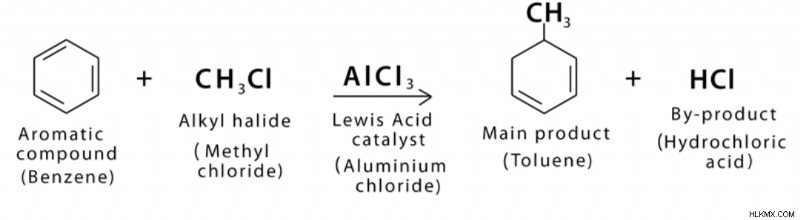
Αυτή η αντίδραση περιλαμβάνει την προσθήκη μιας αλκυλομάδας στο βενζόλιο μέσω μιας ηλεκτρόφιλης αρωματικής αντίδρασης υποκατάστασης—για παράδειγμα, της προσθήκης μιας μεθυλομάδας στο βενζόλιο. Ένας δεσμός pi προσβάλλει ένα καρβοκατιόν από έναν αρωματικό δακτύλιο σε αυτή την αντίδραση. Έτσι το καρβοκατιόν δρα σαν ηλεκτρόφιλο στην αλκυλίωση Friedel-crafts.
Η αντίδραση αλκυλίωσης Friedel Crafts είναι
Χρήσεις αλκυλίωσης στη βιολογία
Ένας από τους πιο συνηθισμένους τύπους αλκυλίωσης, η μεθυλίωση, επηρεάζεται από τη βιταμίνη Β-12 και τα ένζυμα που βασίζονται σε ρίζες SAM στη φύση. Η μεθυλίωση είναι μια χημική αντίδραση που περιλαμβάνει τη μετατόπιση μιας ομάδας μεθυλίου σε κάποια οργανική ένωση. Μπορεί να γίνει μέσω αντίδρασης προσθήκης ή αντίδρασης υποκατάστασης και υπάρχουν δύο τύποι μεθυλίωσης:η χημική μεθυλίωση και η βιολογική μεθυλίωση. Άλλες βιολογικές χρήσεις της αλκυλίωσης είναι:χρησιμοποιείται για τη θεραπεία του καρκίνου του μαστού, του καρκίνου των όρχεων με γεννητικά κύτταρα, του καρκίνου των ωοθηκών και του καρκίνου του πνεύμονα.
Χρήσεις αλκυλίωσης σε προϊόντα καθημερινής χρήσης
Υπάρχουν πολλά προϊόντα καθημερινής χρήσης, όπως πρώτες ύλες και απορρυπαντικά. Για παράδειγμα, το δωδεκυλοβενζόλιο νατρίου λαμβάνεται με την αλκυλίωση του βενζολίου με δωδεκάνιο.
Χρήσεις αλκυλίωσης στη βενζίνη
Η αλκυλίωση διαδραματίζει σημαντικό ρόλο στις εργασίες διυλιστηρίων πετρελαίου με την αλκυλίωση του ισοβουτανίου. Μερικά αλκένια έχουν μικρότερο μοριακό βάρος παρουσία χρωματισμένου οξέος και ζεόλιθου ως καταλύτη. Το αλκυλικό είναι επίσης ένα ουσιαστικό μέρος του αέριου.
Συμπέρασμα
Η αλκυλίωση είναι μια χημική αντίδραση που περιλαμβάνει τη μετατόπιση μιας ομάδας αλκυλίου από το ένα μόριο στο άλλο. Η ομάδα αλκυλίου που μετατοπίζεται δεν είναι δεσμευμένη σε καμία συγκεκριμένη μορφή και μπορεί να υπάρχει σε οποιαδήποτε μορφή όπως καρβανιόν, καρβοκατιόν, ελεύθερη ρίζα, καρβένιο κ.λπ. Η αλκυλ ομάδα είναι ένα αλκάνιο που έχει ένα υδρογόνο λιγότερο από την αλκανική του μορφή. Η αλκυλίωση λαμβάνει χώρα παρουσία ισχυρού οξέος γουίς ή οξέος μαυρίσματος. Υπάρχουν διάφοροι τύποι αλκυλιωτικών παραγόντων όπως οι πυρηνόφιλοι αλκυλιωτικοί παράγοντες στους οποίους το είδος που σχηματίζεται από έναν πυρηνόφιλο αλκυλιωτικό παράγοντα θα είναι καρβανιόν ή ηλεκτροφιλικοί αλκυλιωτικοί παράγοντες, που παράγει καρβοκατιόν. Η πιο κοινή αντίδραση αλκυλίωσης είναι η αντίδραση αλκυλίωσης Friedel Crafts. Υπάρχουν ορισμένοι κίνδυνοι από πυρηνόφιλους αλκυλιωτικούς παράγοντες, όπως είναι τοξικοί και καρκινογόνοι και τείνουν να αλκυλιώνουν το DNA. Κατά συνέπεια, το DNA αντιμετωπίζει προβλήματα περιέλιξης που οφείλεται στο ότι το αλκυλιωμένο DNA δεν περιτυλίσσεται ή δεν ξετυλίγεται σωστά ή δεν μπορεί να υποστεί επεξεργασία από τα συγκεκριμένα ένζυμα που χρησιμοποιούνται για την αποκωδικοποίηση πληροφοριών. Μία από τις πιο κοινές αντιδράσεις αλκυλίωσης είναι η αλκυλίωση Friedel-crafts. Αυτή είναι μια αλκυλίωση που περιλαμβάνει την προσθήκη μιας αλκυλομάδας στο βενζόλιο. Οι αντιδράσεις αλκυλίωσης έχουν μεγάλη χρησιμότητα. Χρησιμοποιούνται εκτενώς στη βιολογία για τη θεραπεία πολλών καρκίνων όπως ο καρκίνος του μαστού, ο καρκίνος του πνεύμονα κ.λπ. Χρησιμοποιείται επίσης στη φύση σε διάφορες βιοχημικές διεργασίες. Χρησιμοποιείται επίσης στην καθημερινή ζωή και στην παραγωγή βενζίνης ως αλκυλικό άλας που έχει αντικτυπητικές ιδιότητες.




